L'atome
L'atome: longtemps considéré comme la pièce la plus infime de la matière, l'atome est un assemblage de particules encore plus petites. Mais alors, pourquoi l'atome est aussi important ? Nous étudierons ici l'évolution de nos connaissances sur la matière présente dans chaque substance et aussi dans les organismes vivants. Petit regret pour ce premier chapitre de chimie: la question "comment sait-on que les atomes existent ?" demeurera sans réponse. L'approche quantitative de la deuxième année nous permettra de l'affronter avec les outils nécessaires.
Origine de l’atome
Un problème de division et d 'échelle
450 avant JC: L'idée atomique est née sur les bords de la mer Egée, il y a presque 2500 ans. Le philosophe grec Leucippe et son disciple Démocrite ont, les premiers, suggéré que toute matière était composée de particules infimes et invisibles à l'œil nu1.
Cette idée a sans doute germé en regardant les plages qu'ils avaient constamment sous les yeux : si on regarde une plage du haut d'une falaise il est impossible de savoir qu'elle est composée de petits grains; pour s'en apercevoir il faut s'en approcher très près; la matière c'est pareil, elle est constituée de petits grains mais à notre échelle il est impossible de s'en apercevoir.
Des réflexions encore plus philosophiques sont venues renforcer leurs idées. En admettant que l'on puisse briser un objet en fragments de plus en plus petits, raisonnaient-ils, il y a forcément un moment où l'on atteint le plus petit morceau de matière qu'il soit possible de casser. Démocrite appela « atomos », qui signifie « qu'on ne peut pas couper », les morceaux ultimes de la matière. Mais un peu plus tard Aristote proposa que toute matière était composée de quatre éléments : l'eau, l'air, la terre et le feu. Toutes les substances contenaient des proportions des quatre éléments. Cette conception perdura jusqu'au début du 19ème siècle.
La conservation de la masse
Fin 18ème siècle : Antoine-Laurent de Lavoisier montre que l’eau n’est pas un élément, car elle se décompose. Il démontre aussi que la masse se conserve, c’est à dire, qu’il n’est pas possible de détruire la matière ou de la créer ( loi de la conservation de la masse) :
……… grammes $\ce{H2}$ + ……… grammes $\ce{O2}$ = ……. grammes $\ce{H2O}$
En 1783, cherchant à identifier le produit de la combustion d'hydrogène en présence d'oxygène, Lavoisier obtient de l'eau. Elle n'est donc pas un élément simple; elle est composée d'hydrogène et d'oxygène. Reste à le démontrer de façon indiscutable. Ainsi, en février 1785 il réalise dans une même expérience l'analyse puis la synthèse de l'eau. Sa démonstration dure trois jours devant un large public. Il fait passer de la vapeur d'eau sur du fer incandescent, ce qui la décompose en hydrogène et en oxygène; les deux gaz sont recueillis chacun dans un gazomètre. Ensuite, les deux gaz mélangés dans un ballon de verre sont enflammés à l'aide d'une étincelle électrique, et l'eau se reforme. Lavoisier montre que l'air atmosphérique est un mélange d'oxygène et d'azote et que l'eau est un corps composé, formé d'oxygène et d'hydrogène. Il met en évidence le rôle de l'oxygène dans les combustions.
Question de proportions
1799 : Joseph-Louis Proust établit la loi des proportions définies, qui dit que « le rapport des masses de chaque réactif qui ont été consommées est constant ». De manière plus simple, on peut affirmer qu'une équation chimique est une recette de cuisine. Si on se retrouve avec huit invités, alors que la recette a été écrite pour quatre personnes, il suffira de doubler la quantité de chaque ingrédient.
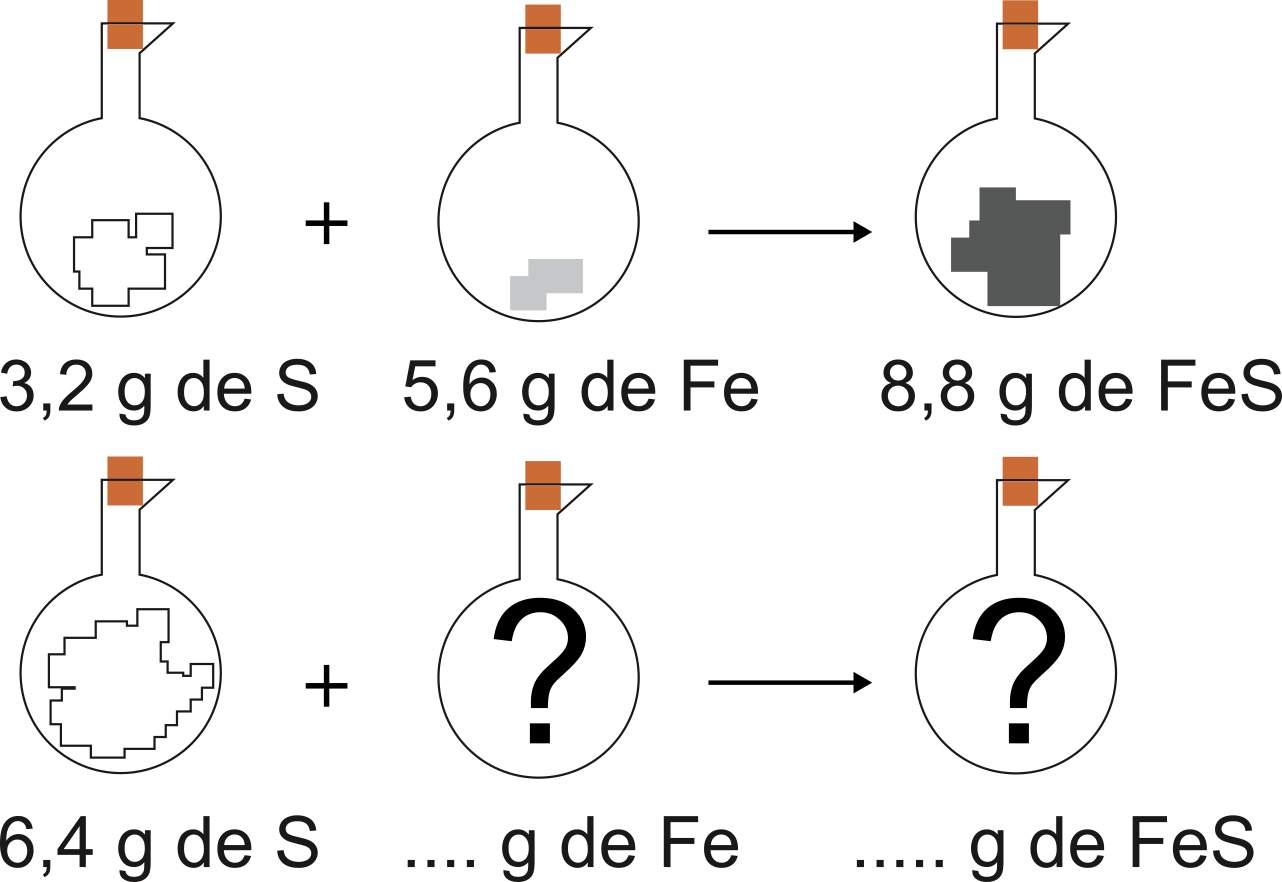
L'expérience de Proust: si l'on double la quantité de soufre, quelle quantité de fer faudra-t-il rajouter? Quelle quantité de sulfure de fer ($\ce{FeS}$) obtiendra-t-on ?
Théorie atomique de Dalton
1808 : le scientifique anglais, John Dalton, qui s’intéresse à la météorologie, se pose la question suivante :
Pourquoi les constituants de l'air (azote, oxygène, $\ce{CO2}$, vapeur d'eau) ne se séparent-ils pas par ordre de densité (du gaz carbonique le plus lourd qui se maintiendrait au niveau du sol jusqu'à la vapeur d'eau, la plus légère, qui se situerait aux grandes altitudes) et pourquoi ce mélange de gaz reste-t-il constamment homogène ?
Dalton admet que les gaz sont formés de petites particules qui sont toujours en mouvement. Il propose que les particules ou les atomes d'un corps simple sont semblables entre elles, mais elles sont différentes lorsqu'on passe d'un corps à un autre. Il démontre que chaque substance est constituée de particules très petites (molécules et atomes) identiques. John Dalton est le créateur de la théorie atomique.
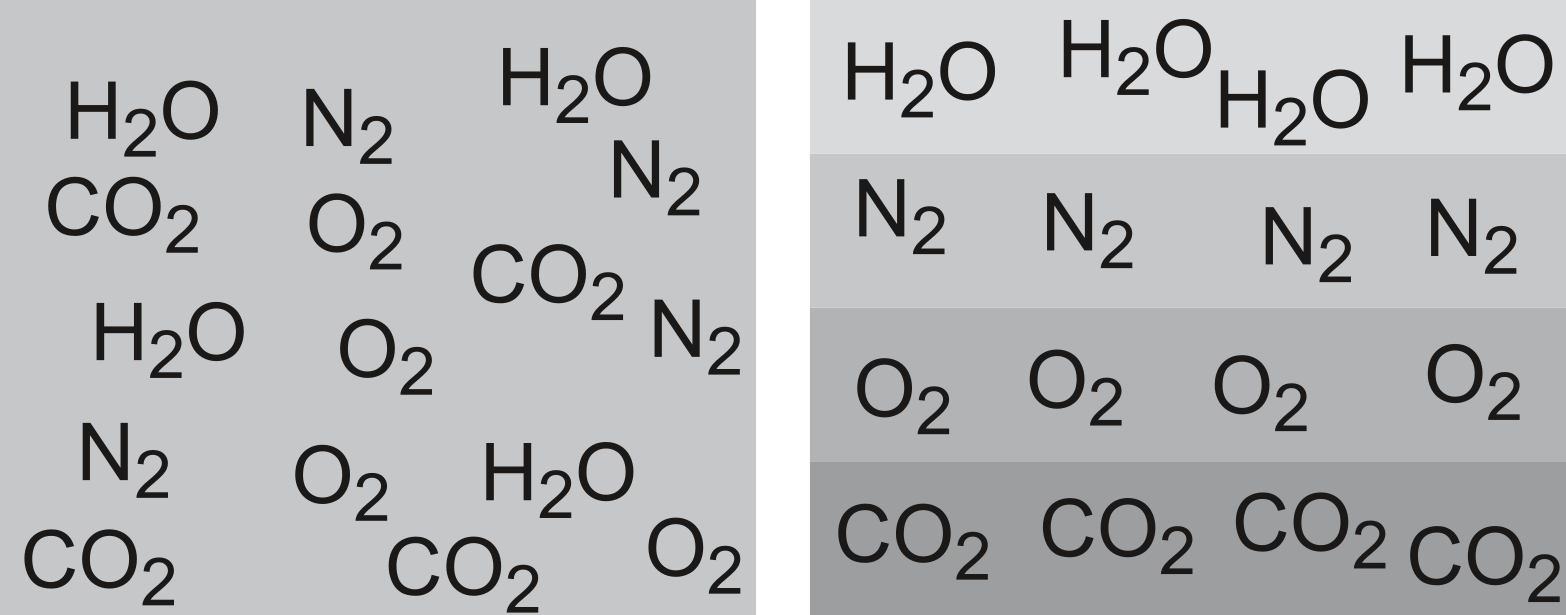
Echantillon d'air: l'air est-il un mélange homogène ou hétérogène ?
Les points de la Théorie Atomique de Dalton …
- La matière est composée de petites particules invisibles et indivisibles nommées atomes.
- Les particules d’une même substance sont identiques, y compris leur masse.
- Les atomes d’éléments différents ont des propriétés et des masses différentes.
- Les atomes ne peuvent pas être ni créés ni détruits lors de transformations physiques ou chimiques.
Aujourd’hui, on sait que les points 2 (les atomes d’un élément n’ont pas exactement la même masse) et 4 de la théorie de Dalton ne sont pas tout à fait exacts (nous pouvons créer et détruire des atomes, même si ce n’est jamais le cas au cours de réactions chimiques). Pour Dalton, l’atome est comme une bille homogène. Dalton est le père du premier modèle atomique.
Le modèle atomique
Notion de modèle
En chimie et en physique, un modèle est une représentation de la réalité. Ce n'est donc pas la réalité. Cette représentation est élaborée progressivement à partir des observations. Un modèle doit posséder deux vertus:
- Permettre d'expliquer les propriétés observées,
- Permettre de prévoir d'autres propriétés non encore observées.
Un modèle est en permanente évolution puisque de nouvelles découvertes sont susceptibles de le mettre en défaut.
Enfin c'est souvent l'étude des défauts d'un modèle qui permet d'approfondir nos connaissances en chimie.
L'électron identifié
1897: Joseph Thomson montre que la lumière (rayons cathodiques), qui est émise par la cathode (électrode négatif), est déviée lorsqu'elle passe entre deux plaques métalliques chargées.
Exercice

L’expérience de Thomson
Cette lumière n’est donc pas une onde (qui ne peut être déviée) mais un ensemble de particules négatives, dont il parvient même à calculer le rapport charge-masse (=$1,7\times10^{11}\,\mathrm{C/kg}$). Thomson nomme électrons ces vecteurs d'électricité et propose un premier modèle de l'atome.

Thomson imagine que l'atome ressemble à un cake aux raisins: les électrons sont des petits raisins chargés négativement dans un cake positif. Les atomes sont des corps solides.
L’atome : un système solaire miniature
1908 : Ernest Rutherford bombarde avec des particules alpha (de charge positive) des fines feuilles d'or. La quasi-totalité des projectiles traverse l'obstacle en ligne droite, prouvant que la matière est surtout faite de vide. Quelques particules, cependant, ont été déviées dans leur course, comme repoussées par un objet de même charge.

L’expérience de Rutherford sur la feuille d’or: seuls les projectiles qui butent sur un noyau sont déviés.
La majeure partie de la masse de l'atome, estime Rutherford, doit être concentrée dans un petit noyau positif. Ces résultats conduiront Rutherford à proposer, en 1910, un modèle atomique dans lequel toute la masse de l'atome est concentrée dans le noyau, alors que les électrons tout légers lui gravitent autour. Les atomes sont principalement constitués de vide2.
Dans le cas de l'atome d'or, il y a donc un rapport de $10^4$ entre le rayon de l'atome et son noyau ! On comprend alors pourquoi on dit que l'atome est composé à $99,95\%$ de vide. Et pour l'atome d'hydrogène, ce rapport passe à $10^5$ !

Si le noyau d'hydrogène avait la taille d'un petit pois, la taille de l'atome s'apparenterait à celle d'un stade de foot !
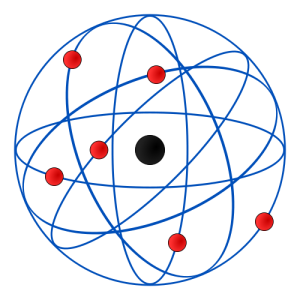
Modèle nucléaire d'après Rutherford. Ce modèle pose un problème: un électron qui gravite autour du noyau d'un atome devrait dégager de l'énergie et, par conséquent, rapidement s'écraser sur le noyau.
1913 : Niels Bohr améliore le modèle de Rutherford et conclut que l’électron se déplace autour du noyau fixe, en décrivant des trajectoires circulaires, centrées sur le noyau, et appelées orbites. Ce modèle est comparable au système solaire et est ainsi dit "modèle planétaire": autour d'un noyau "soleil" positif gravitent des électrons " planètes" chargés négativement.

L’atome d’oxygène, selon le modèle de Bohr: sur une orbite donnée, l'énergie de l'électron ne varie pas (état stationnaire). L’électron ne peut donc gagner ou perdre de l'énergie qu’en passant d'une orbite à une autre.
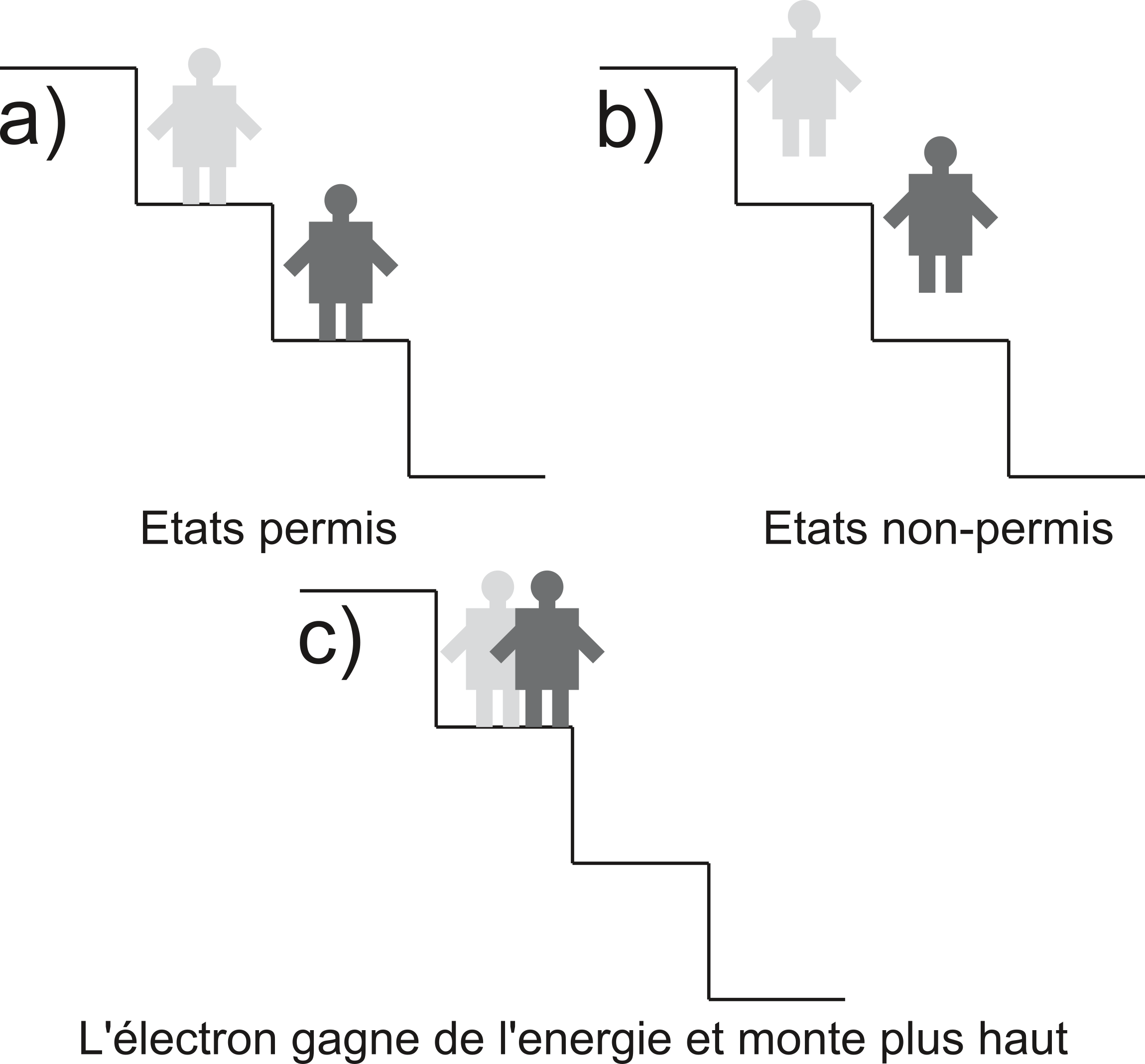
Dans cette figure, l’électron est imaginé comme un bonhomme. Chaque marche de l’escalier correspond à une orbite du modèle de Bohr (cf figure suivante).

Modèle de Bohr: remarquez l’analogie entre « les marches de l’escalier » et les orbites (= trajectoires circulaires autour du noyau).
Le modèle probabiliste - le modèle d’aujourd’hui
Exercice
1925 : une nouvelle théorie (la mécanique quantique) soutient que les électrons ne sont en fait ni des billes ni des planètes, mais des sortes de nuages ! Werner Heisenberg démontre qu'il est impossible de connaître en même temps la vitesse et la position d'une particule. Tout ce que l’on peut prévoir, ce n’est rien d’autre que la probabilité de trouver un électron en chaque point de l’espace, et non la position précise de l’électron à chaque instant ! Pour l’électron autour du noyau, il n’y a pas de trajectoire précise comme c’était prévu dans le modèle planétaire ; il n’y a pas d’orbite ! Les électrons ne sont pas à une distance fixe. Nous pouvons nous imaginer les électrons autour du noyau comme faisant partie d’un nuage électronique.
1932 : la composition de l'atome sera définitivement établie. James Chadwick a découvert une particule dans le noyau de l’atome qui ne portait pas de charge. Il a appelé cette particule le neutron. Le noyau apparaît comme un assemblage de "grains de matière" positifs et neutres, appelés respectivement "protons" et "neutrons". Autour du noyau existe une série d’orbitales centrées sur le noyau et dans laquelle il y a une certaine probabilité de trouver les électrons.
La structure de l’atome
Un atome est neutre: le nombre de protons ($p^+$) est égal au nombre d'électrons ($e^-$).
Les nucléons
Les particules, neutrons et protons, qui constituent le noyau sont nommées les nucléons. Il faut mémoriser que la charge électrique portée par le proton est notée et appelée: charge élémentaire. C'est la plus petite charge électrique stable que l'on puisse isoler.
Les nombres $Z$ et $A$.
- Le nombre de charge ou numéro atomique $Z$ d'un noyau est le nombre de protons qu'il contient.
- $A$ représente le nombre de masse. Il est égal à la somme du nombre de protons et de neutrons.
| Nombre | Signification |
|---|---|
| $Z$ | nombre de protons |
| $A$ | nombre de protons + nombre de neutrons |
On convient de représenter le noyau d'un atome par le symbole :
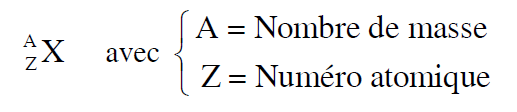
On convient de représenter le noyau d'un atome par le symbole : ${_Z^A}\ce{X}$
Dans ce symbole, $\ce{X}$ représente un élément. Par exemple $\ce{O}$: oxygène, $\ce{Cl}$: chlore, $\ce{N}$: azote. Si l'on note $N$ le nombre de neutrons du noyau on a: $A=Z+N$.
| Particule | Symbole | Charge | Masse [$kg$] | Masse [$u$] |
|---|---|---|---|---|
| électrons | $e^-$ | $1-$ | $9,101\times 10^{-31}$ | $\sim 0$ |
| protons | $p^+$ | $1+$ | $1,673\times 10^{-27}$ | $\sim 1$ |
| neutrons | $n^0$ | $0$ | $1,675\times 10^{-27}$ | $\sim1$ |
Les charges sont données en multiples de la charge d'un proton, qui est égale à
$1,675\times 10^{-19}C$.
$1$ unité de masse atomique (de symbole $u$) correspond à $1,6605\times 10^{-27}kg$.
Il n'est pas nécessaire de retenir la valeur de la masse de l'électron. Par contre lui est utile de savoir que cette masse est beaucoup plus petite que celle d'un nucléon (environ $2000$ fois plus petite) ce qui nous autorise à négliger la masse des électrons devant celle des nucléons. La masse absolue des atomes importe peu au chimiste qui ne doit connaître que la masse relative des atomes. La masse relative est la masse comparée à la masse d'un atome déterminé, prise comme unité. Parmi différentes possibilités, on a adopté en 1961 le carbone (isotope $12$) comme base de calcul des masses atomiques. Définition : l'unité de masse atomique ($u$) est exactement le douzième de la masse d'un atome de carbone.
$$1\,\mathrm{u} = 1,6605\times 10^{-27}\,\mathrm{kg}$$
Comme les électrons ont une masse négligeable, la masse des protons ($Z$) ajoutée à la masse des neutrons ($N$) donne le nombre de masse ($A$): cela implique que la masse de l'atome est essentiellement concentrée dans son noyau.
Exercice
| Atome | Nombre de protons | Nombre d'électrons | Nombre de neutrons |
|---|---|---|---|
| $\ce{^{23}_{11}Na}$ | |||
| $\ce{^{16}_{8}O}$ | |||
| $\ce{^{197}_{79}Au}$ |
L'élément chimique
Définition
On donne le nom d'élément chimique à l'ensemble des atomes, caractérisés par le même nombre $Z$ de protons présents dans leur noyau.
Symboles des éléments
Nous connaissons à ce jour 118 éléments. Chaque élément est représenté par un symbole composé d'une lettre majuscule (ex: élément iode $\ce{I}$) ou d'une majuscule suivie d'une minuscule (ex: élément magnésium $\ce{Mg}$). Voici une première liste des éléments les plus fréquemment rencontrés en chimie à notre niveau:
| Nom | $Z$ | Symbole | Nom | $Z$ | Symbole |
|---|---|---|---|---|---|
| Hydrogène | $1$ | $\ce{H}$ | Soufre | $16$ | $\ce{S}$ |
| Carbone | $6$ | $\ce{C}$ | Chlore | $12$ | $\ce{Cl}$ |
| Azote | $7$ | $\ce{N}$ | Fer | $26$ | $\ce{Fe}$ |
| Oxygène | $8$ | $\ce{O}$ | Cuivre | $29$ | $\ce{Cu}$ |
| Fluor | $9$ | $\ce{F}$ | Zinc | $30$ | $\ce{Zn}$ |
| Sodium | $11$ | $\ce{Na}$ | Brome | $35$ | $\ce{Br}$ |
| Aluminium | $13$ | $\ce{Al}$ | Argent | $47$ | $\ce{Ag}$ |
Les isotopes
La spectrométrie de masse est une technique que l’on peut utiliser pour déterminer la masse d’un atome. Cette technique de mesure a conduit à une découverte majeure. On a découvert que tous les atomes d’un même élément n’ont pas la même masse. La masse d'un atome étant déterminée pratiquement par la somme de ses protons et ses neutrons, on en conclut que la variation de la masse est due au nombre de neutrons. Les isotopes sont donc des atomes ayant tous le même nombre de protons mais pouvant posséder un nombre variable de neutrons.
Exercice

Les trois isotopes naturels du néon
Masse atomique dans le tableau périodique
Pour un élément chimique, la masse atomique indiquée sur le tableau périodique est la masse moyenne pondérée de tous les isotopes de cet élément. Elle tient donc compte de l'abondance relative de chaque isotope. Cette donnée décrit la proportion des divers isotopes naturels d'un même élément.
Exercice

Que vaut la masse atomique moyenne de cet échantillon de néon?
Exercices SERIE A - L’atome

Référez-vous à la théorie vue dans ce cours
| Réaction | mg analysé | mg de mercure | mg de chlore |
|---|---|---|---|
| no. 1 | $294,8$ | $250,5$ | $44,3$ |
| no. 2 | $479,3$ | $354,1$ | $125,2$ |
| no. 3 | $613,3$ | $521,2$ | $92,1$ |
| no. 4 | $892,3$ | $659,2$ | $233,1$ |
| Atome | Nombre de protons | Nombre de neutrons |
|---|---|---|
| $\ce{^{238}_{94}Pu}$ | ||
| $\ce{^{65}_{29}Cu}$ | ||
| $\ce{^{52}_{24}Cr}$ | ||
| $\ce{^{4}_{2}He}$ | ||
| $\ce{^{60}_{27}Co}$ | ||
| $\ce{^{54}_{24}Cr}$ |
Structure électronique
Un atome quelconque possède $Z$ électrons dans son cortège électronique. Les électrons d'un atome quelconque se répartissent autour du noyau en couches électroniques d’énergies différentes. La couche la plus proche du noyau est notée par le chiffre $1$, les suivantes sont notées dans l'ordre croissant d'éloignement: $2$, $3$, $4$, $5$, $6$, $7$. Il y a donc $7$ couches en tout. Les électrons d'un atome ne sont pas tous liés de la même façon au noyau. Ceux qui sont proches du noyau y sont très liés, ceux qui en sont plus éloignés y sont moins liés. Une couche électronique ne peut contenir qu'un nombre limité d'électrons. Dans le tableau ci-dessous vous trouvez le nombre maximal d’électrons pour chaque couche.
| Couche | Nombre d'électrons au maximum |
|---|---|
| 1ère | $2 $ |
| 2ère | $8$ |
| 3ème | $18$ |
| 4ème | $32$ |
| 5ème | $32$ |
| 6ème | $18$ |
| 7ème | $8\, ...$ |
On appelle structure ou configuration électronique la répartition des électrons dans les différentes couches. A l’intérieur des couches, les électrons se groupent par paires, dans les orbitales. On symbolise ces dernières par des cases. Une orbitale ne peut donc contenir au maximum que deux électrons, formant une paire ; si elle ne renferme qu'un seul électron, on parle d'électron célibataire. La couche la plus éloignée du noyau qui contient des électrons est appelée couche externe. Les électrons de cette couche externe sont appelés électrons externes (ou périphériques). La structure électronique de la dernière couche joue un rôle essentiel dans toute la chimie, c'est grâce à elle que nous allons pouvoir prédire comment se comportera chaque atome. Dans le tableau périodique, en haut de chaque colonne, figure la répartition des électrons externes en paires ($p$) ou célibataires ($c$). On appelle les électrons des couches internes électrons de cœur.
Répartition des électrons d'un atome
Les règles de remplissage suivantes permettent d'établir la répartition électronique d'un atome, à l’aide du tableau ci-dessus.
- On détermine le nombre d'électrons à repartir ($Z$ électrons pour un atome).
- On remplit d’abord la case la plus basse (couche $1$). On place donc les électrons dans l’ordre d’énergie croissante.
- A l’intérieur d’une couche, on place un électron par case (chaque case est une orbitale différente).
- Si plusieurs cases sont sur la même couche, on place d’abord un électron par case.
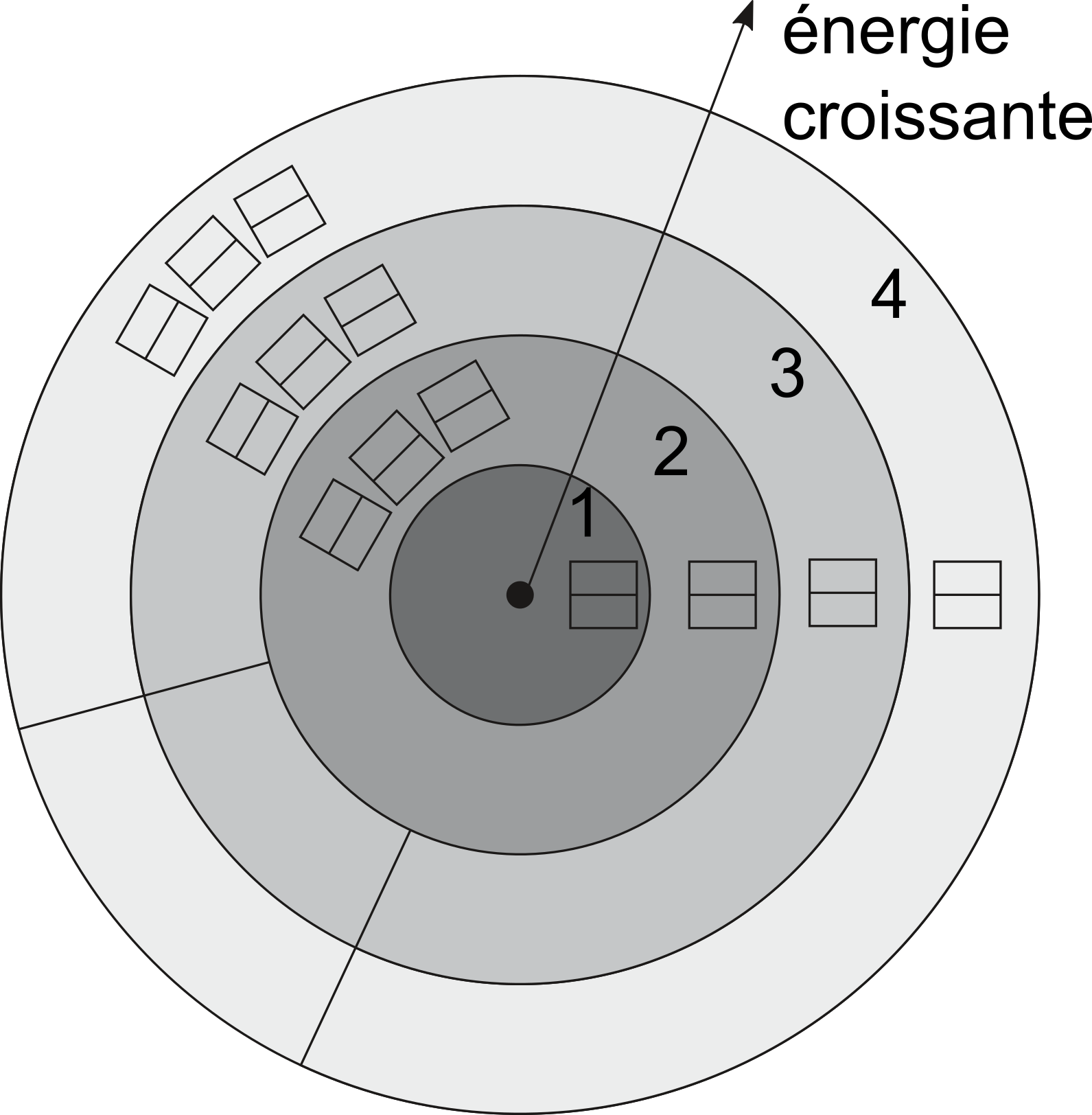
Modéle électronique de l'atome: on ne montre que les 2 premières couches complètes et une partie de la 3ème et 4ème couche.
Le modèle simplifié ci-dessus est applicable pour les éléments chimiques de $Z < 20$.
Ce modèle permet de visualiser la répartition électronique des atomes.
Remarque : Les règles de répartitions données ci-dessus concernent ce que nous appellerons l'atome dans son état activé. Lors de la liaison avec d'autres atomes, les éléments des colonnes II A, III A et IV A organisent leurs électrons externes pour disposer d'un nombre maximum d'électrons célibataires.
Le tableau périodique des Tables CRM utilisé dans ce cours, vous donne la structure activée de ces éléments.
Exercice
Atome de ......................
Exercice

Atome de ......................
Une nouvelle unité de quantité de matière: la mole
Nécessité d'un changement d'échelle
La masse d'un atome où d'une molécule est très petite (de l'ordre de $10^{-26}\,\mathrm{kg}$). De ce fait, les réactions chimiques font intervenir un nombre considérable d'entités chimiques. A titre d'exemple, un clou de masse $12,46\,\mathrm{g}$ contient environ $1,3\times10^{23}$ atomes. Le nombre obtenu n'est évidemment pas pratique à manipuler car il s'agit d'un nombre extrêmement grand. Ce calcul met en évidence la nécessité d'introduire une nouvelle échelle, plus commode, pour manipuler des quantités de matière en chimie. D’ailleurs, les balances au laboratoire nous ne permettraient de mesurer la masse d’un atome ou d’une molécule.
Définition de la mole
D'après ce qui précède, il est nécessaire de définir une nouvelle unité de quantité de matière. En prenant une grande quantité d'atomes, une mole, on obtient un ensemble mesurable d'un point de vue macroscopique. Nous pouvons peser, par-exemple, la masse d'une mole de sel de cuisine ($\ce{NaCl}$) avec une simple balance alors qu'on ne peut pas peser la masse d'une molécule de $\ce{NaCl}$.
Nombre d'Avogadro
Le nombre d'atomes contenus dans une mole de carbone est appelé nombre d'Avogadro et sera noté $NA$. Ce nombre vaut $6,022\times10^{23}\,\mathrm{mol}^{-1}$. Une mole d'une substance possède une masse qui lui est spécifique3.
Une mole représente une quantité de matière composée de $6,022\times10^{23}$ entités élémentaires.
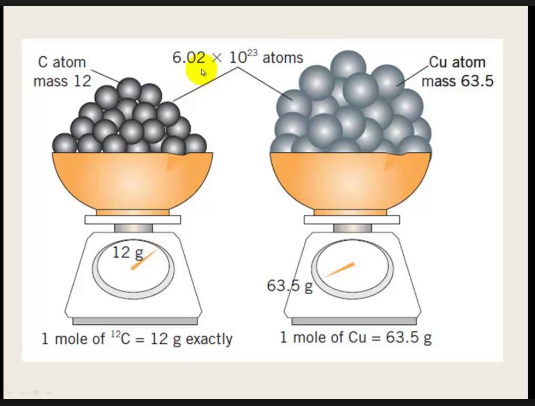
Une mole de carbone et une mole de cuivre: bien qu'elles contiennent le même nombre d'atomes, leur masse est différente. Pourquoi?
Masses molaires
Masse molaire atomique
La masse molaire atomique d'un élément est la masse d'une mole d'atomes de cet élément, les proportions des différents isotopes étant celles que l'on rencontre dans la nature. La masse molaire atomique est une quantité de substance égale à la masse atomique (en $u$) de cette substance exprimée en $g$. Les masses molaires atomiques figurent dans le tableau périodique des éléments.
Exercice
$M(\ce{Cu})$=......... $\mathrm{g/mol}$; $M(\ce{I})$=…......$\mathrm{g/mol}$; $M(\ce{Be})$=.........$\mathrm{g/mol}$
Masse molaire moléculaire
La masse molaire moléculaire est la masse d'une mole de molécules de l'espèce considérée. On la calcule en effectuant la somme des masses molaires atomiques des atomes qui constituent la molécule.
Exemple:
\begin{align} &M(\ce{H2O}) = 2\times M(\ce{H}) + M(\ce{O}) \\ &M(\ce{H2O}) = 2\times 1+16 \\ &M(\ce{H2O}) = 18\,\mathrm{g/mol} \end{align}
Classification périodique des éléments
Mendéléïev (1834-1907) eut l'idée de classer les éléments, connus à son époque, en colonnes et en lignes par ordre de masses molaires atomiques croissantes, de telle manière que les éléments figurant dans une même colonne présentent des propriétés chimiques semblables.
Classification moderne.
Remarques générales.
Cette classification comporte $7$ lignes (ou périodes) et $18$ colonnes. Les éléments sont rangés dans chaque ligne par ordre croissant du numéro atomique $Z$.
Présentation du tableau périodique
En examinant le tableau périodique on peut s'apercevoir que:
- Dans une même ligne (ou période), les atomes des éléments ont le même nombre de couches électroniques occupées. Première ligne: couche 1, deuxième ligne: couche 2, troisième ligne: couche 3, etc.……..
- Le parcours d'une ligne correspond au remplissage d'une couche électronique, les couches inférieures étant saturées.
- Dans une même colonne, les atomes des éléments ont le même nombre d'électrons dans la couche externe. Les atomes des éléments de la colonne (1) ont $1$ électron sur la couche externe, ceux de la colonne (2) en ont $2$ sur la couche externe, etc.
Familles chimiques
Les propriétés chimiques des atomes des différents éléments (transformation en ions monoatomiques ou capacité à établir une ou plusieurs liaisons covalentes) dépendent essentiellement du nombre d'électrons présents dans leur couche externe. Or les atomes des éléments appartenant à une même colonne du tableau périodique possèdent justement le même nombre d'électrons dans leur couche externe. On peut donc légitimement supposer que les atomes des éléments d'une même colonne ont des propriétés très semblables, même si elles ne sont pas rigoureusement identiques. On dit que les éléments d'une même colonne constituent une famille chimique.
- Les éléments de la première colonne, notée (1), (à l'exception de l'hydrogène) constituent la famille des métaux alcalins.
- Les éléments de la deuxième colonne, notée (2), constituent la famille des métaux alcalino-terreux.
- Les éléments de la dix septième colonne, notée (7) dans la présentation réduite, constitue la famille des halogènes.
- Les éléments de la dix huitième colonne, notée (8) dans la présentation réduite, constitue la famille des gaz rares (ou gaz inertes).
Si l'on considère la structure électronique des éléments du point de vue du nombre des électrons externes et de leur répartition, on distingue dans le tableau périodique :
- Les éléments des familles A dont les électrons externes sont tous placés dans la même couche électronique. Exemple :
- Les éléments (métaux) de transition des familles B dont les électrons externes sont placés dans deux couches différentes. Exemple :
Aux conditions ambiantes:
| Caractéristiques des métaux | Caractéristiques des non-métaux |
|---|---|
| Bons conducteurs électriques et thermiques | Mauvais conducteurs électriques et thermiques |
| Malléables, éclat métallique | Non malléables |
| solides, tous sauf un, lequel? ... | solides, liquides ou gazeux |
| point de fusion élevé | point de fusion peu élevé |
Exercices SERIE B - L’atome
| Symbole du noyau | Nom de l'élément | Nombre de protons | Nombre d'électrons | Nombre de masse $A$ | Nombre de neutrons |
|---|---|---|---|---|---|
| $ _{19}^{39}\ce{K}$ | |||||
| arsenic | $47$ | ||||
| $24$ | $52$ | ||||
| $22$ | $26$ | ||||
| $2$ | $2$ |
| Quantité de $\ce{Tl2SO4}$ | Effet sur le rat |
|---|---|
| $1,3\times 10^{-2}\,\mathrm{g}$ | ¤ Il survit ¤ Il meurt |
| $2,0\times 10^{-5}\,\mathrm{mol}$ | ¤ Il survit ¤ Il meurt |
| $1,8\times 10^{19}$ molécules | ¤ Il survit ¤ Il meurt |
Bibliographie
Voici quelques liens consultés et/ou repris tels quels. Merci à leurs auteurs pour le précieux partage de ces ressources: