Électrolyse
L'électrolyse est un processus électrochimique qui permet de provoquer des réactions chimiques non spontanées en fournissant de l'énergie électrique. Contrairement aux réactions spontanées observées dans les piles galvaniques, où l'énergie chimique est convertie en énergie électrique, l'électrolyse nécessite un apport externe d'électricité pour induire une transformation chimique. En effet, lors d'une électrolyse, on applique une tension électrique entre deux électrodes immergées dans une solution électrolytique. Cette tension crée un champ électrique qui induit le déplacement des ions dans la solution, générant ainsi un courant électrique. Ce courant est le résultat du mouvement des ions sous l'effet de la tension appliquée. Ainsi, la tension est la cause initiale, et le courant est la conséquence de cette tension appliquée.
Schéma
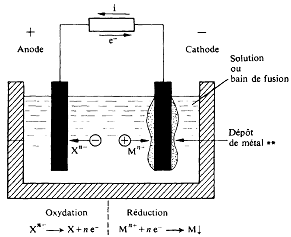
Illustration d'une électrolyse : le revêtement métallique d’un support.
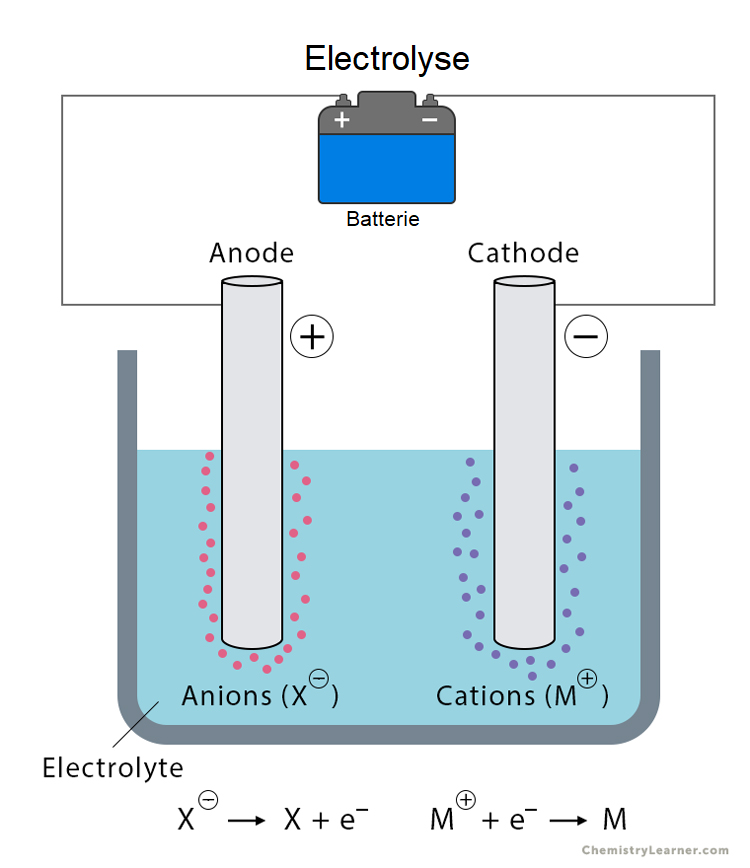
Le schéma d'une électrolyse.
Une expérience d'électrolyse se déroule de la manière suivante :
-
Préparation du circuit : deux électrodes conductrices (par exemple, en platine ou en graphite) sont immergées dans une solution électrolytique contenant des ions mobiles. Ces électrodes sont reliées à un générateur de courant continu.
-
Connexion au générateur : le générateur est activé pour fournir une tension continue entre les deux électrodes. L'électrode connectée à la borne positive du générateur devient l'anode, tandis que celle reliée à la borne négative devient la cathode.
-
Établissement du champ électrique et début du courant : la tension appliquée crée un champ électrique dans la solution, entraînant immédiatement la migration des ions : les cations (ions positifs) se dirigent vers la cathode et les anions (ions négatifs) vers l'anode. Ce mouvement d'ions constitue un courant électrique traversant la solution.
-
Déclenchement des réactions électrochimiques : aux interfaces électrode-solution, des réactions d'oxydation et de réduction se produisent, modifiant la composition chimique du système.
-
Contrôle de l'électrolyse : l'intensité du courant et la durée d'application de la tension sont ajustées en fonction des objectifs expérimentaux (quantité de matière à transformer, rendement, etc.).
Étude qualitative
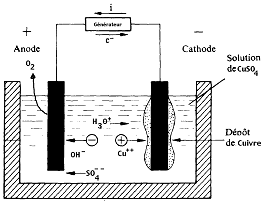
Un cas spécifique: l'électrolyse du cuivre.
Prenons le cas, illustré ci-dessus, de l'électrolyse d'une solution de $\ce{CuSO4}$.
L'électrolyte est formé de : $\ce{CuSO4 → Cu^2+ + SO4^{2 -}}$ et $\ce{H2O}$
Phénomènes aux électrodes
Cathode (borne -)
Les ions $\ce{Cu^{2+}}$ captent deux électrons cédés par la cathode en formant un dépôt de $\ce{Cu}$. Il s'agit donc d'une réduction.
$$\ce{Cu^2+ + 2e^- → Cu}$$
Anode (borne +)
Chaque molécule d'eau cède deux électrons captés par l'anode. Il s'agit donc d'une oxydation.
$$\ce{2 H2O – 4e^- → 4 H+ + O2}$$
Étude quantitative
Loi de Faraday
Soit :
$$\ce{A^{n+} + n\cdot e- → A^{0}}$$
Quand $x$ moles de cation $\ce{A^{n+}}$ se réduisent en $\ce{A^{0}}$ sur une électrode, il a eu besoin de $n\cdot x$ moles d'électrons correspondant à une charge totale [$\mathrm{Q}$] :
| constante de Faraday = $96500\,\mathrm{[C/mol]}$ | charge d'un électron = $1,6·10^{-19}\,\mathrm{[C]}$ |
| nombre d'Avogadro = $ 6,022\cdot 10^{23}\,\mathrm{[mol^{-1}]}$ | Q = charge totale $\mathrm{[C]}$ |
La quantité de matière qui se forme ou qui disparaît aux électrodes est proportionnelle à l’intensité du courant $\mathrm{(i)}$ et à la durée de l'électrolyse $\mathrm{(t)}$.
Loi de Faraday : $\mathrm{Q} = \mathrm{i}\cdot \mathrm{t}$ = quantité d'électricité en coulomb $\mathrm{[C]}$
où
$\mathrm{i}$ = courant en ampère $\mathrm{[A]}$
$\mathrm{t}$ = temps en seconde $\mathrm{[s]}$
L’exemple suivant illustre l’utilisation du raisonnement qui a permit de dériver la loi de Faraday.
EXEMPLE
$\ce{Al^{3+} + 3e- → Al}$
On veut obtenir $54\,\mathrm{g}$ d’$\ce{Al}$ = $2$ moles d’$\ce{Al}$.
On aura besoin de $2 · 3/1$ = $6$ moles d’électrons
$Q= 6 \,\mathrm{mol} · 96500 \,\mathrm{C/mol}= 579000\,\mathrm{C}$
Si l’on applique une intensité de courant de $100\,\mathrm{[A]}$, la durée de l’expérience sera égale à $t=579000/100=5790\,\mathrm{s}$.
Applications
Production d’aluminium par électrolyse
L'aluminium est produit industriellement par électrolyse de l'alumine ($\ce{Al2O3}$) dissoute dans un bain de cryolithe fondue ($\ce{Na3AlF6}$), selon le procédé Hall-Héroult. Ce processus, réalisé à environ 950 °C, permet d'obtenir de l'aluminium liquide à la cathode, tandis que l'anode en carbone est consommée, générant du dioxyde de carbone. La cryolithe sert à abaisser le point de fusion de l'alumine et est un excellent électrolyte.
La réaction d'électrolyse est la suivante:
$${\displaystyle {\rm {2Al_{2}O_{3}(solution)+3C(solide)\rightarrow 4Al(liquide)+3CO_{2}(gaz)}}}$$
Le schéma très simplifié d’une cellule (à compléter !):
Production de chlore par électrolyse
Le chlore est produit industriellement par électrolyse d'une solution aqueuse de chlorure de sodium (saumure), un procédé qui génère simultanément du chlore gazeux ($\ce{Cl2}$), de la soude caustique ($\ce{NaOH}$) et du dihydrogène ($\ce{H2}$)

Le schéma très simplifié d’une cellule (à compléter !):
Affinage du cuivre
L'affinage industriel du cuivre brut s'effectue par électrolyse d'anodes de cuivre brut dans un bain de sulfate de cuivre. Le cuivre pur ( jusqu'à 99,95 %) se fixe sur la cathode, les impuretés restant dans le bain.

Le schéma très simplifié d’une cellule (à compléter !):
Copie métallique de statue
On appelle galvanoplastie l’ensemble des procédés permettant de déposer, par électrolyse, un revêtement sur un métal. On peut citer par exemple, la dorure, l’argenture, le platinage, le cuivrage, le nickelage, ainsi que les dépôts de peinture, la fabrication d’empreintes…
Complétez les légendes sur le croquis ci-dessous pour expliquer le procédé.
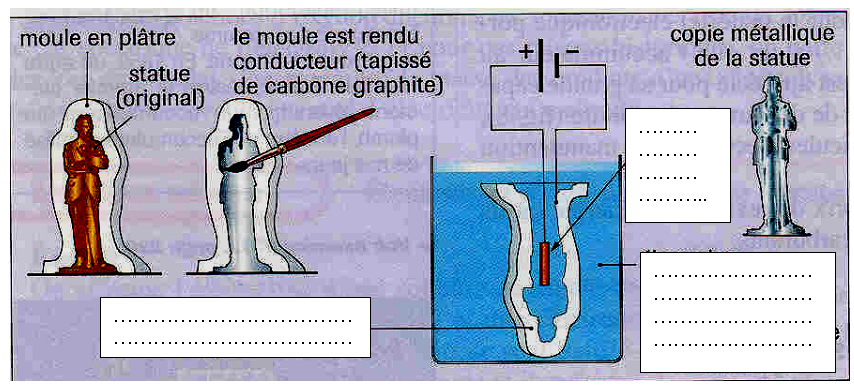 |
|---|
L'illustration du procédé de galvanoplastie. |
Série Exercices Electrolyse
Quelles sont les similitudes et les différences entre une pile et l'électrolyse ?
Quels sont les produits formés lors de l'électrolyse de l'eau ?
| Donnez les équations des réactions et complétez le schéma à droite | 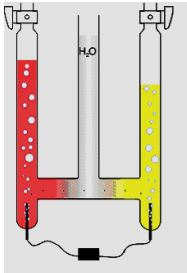 |
|---|---|
L'appareil de Hoffmann |
Que devient le pH aux électrodes pendant l'électrolyse de l'eau ?
Donnez les équations de réactions lors de l'électrolyse du $\ce{NaCl}$ fondu (pas d’eau).
On électrolyse une solution neutre de chlorure de cobalt (II), durant $30\,\mathrm{min}$ avec un courant d'intensité égale à $3\,\mathrm{[A]}$.
Donnez les équations des réactions se produisant aux électrodes.
Quelle est la masse de cobalt métallique déposée à la cathode ?
Quel est le volume de dichlore produit à l'anode ? (rappel : $1\,\mathrm{ [mol]}$ de gaz parfait = $22,4\,\mathrm{[L]}$)
Quelle est la masse de zinc pouvant être réduite à la cathode avec un courant de $4\,\mathrm{[A]}$ pendant $15\,\mathrm{[min]}$ ?
On fait une électrolyse d'une solution d'alumine $\ce{Al2O3}$, dissous dans un bain de fusion à $960\,\mathrm{ °C}$. Quelle doit être la durée de l'opération pour obtenir $300\,\mathrm{[kg]}$ de métal avec un courant d'intensité constante égale à $104\,\mathrm{[A]}$ ?
Quelle intensité de courant faut-il pour déposer $0,5\,\mathrm{[g]}$ de chrome lors d'un chromage pendant $1$ heure avec une solution de $\ce{Cr^2+}$.
On met en solution $0,369\,\mathrm{[g]}$ d'un minerai de fer qui ne contient au départ que du fer sous forme de $\ce{Fe^2+}$. On dose le $\ce{Fe^2+}$ en milieu acide par une solution de permanganate de potassium. On a dû utiliser $16,5\,\mathrm{[mL]}$ d'une solution étalon de permanganate de potassium de $0,01\,\mathrm{[mol/L]}$. Calculer le pourcentage en fer dans le minerai. (Note : la forme la plus stable du manganèse est $\ce{Mn^2+}$).
Lors de l'électrolyse d'une solution aqueuse acide, l'hydrogène se dégage à la cathode, et on récolte $112\,\mathrm{[mL]}$ de dihydrogène mesuré aux conditions normales de température et pression (= CNTP ; rappel : aux CNTP, $1\,\mathrm{mol}$ de gaz occupe un volume de $22,4\,\mathrm{[L]}$). L'équation de la réaction est :
$$\ce{2 H2O + 2e- → H2 + 2 OH^{-} }$$
Calculez la quantité d'électricité en $\mathrm{[C]}$ ayant traversé l'électrolyte.
Calculez la durée de l'opération sachant que l'intensité du courant est de $2\,\mathrm{[A]}$.
On électrolyse $100\,\mathrm{[kg]}$ d’alumine $\ce{Al2O3}$. On suppose que l’oxygène formé ne donne, avec le carbone de l’anode, que du monoxyde de carbone. Calculez :
la masse et le volume de monoxyde de carbone obtenu (aux CNTP; rappel : aux CNTP, $1\,\mathrm{mol}$ de gaz occupe un volume de $22,4\,\mathrm{[L]}$).
la diminution de la masse de l’anode.
la durée de l’électrolyse sachant que l’intensité du courant est de $10^4\,\mathrm{[A]}$?
Quels volumes d’oxygène et d’hydrogène (aux CNTP) obtiendra-t-on par électrolyse de l’eau pendant $1$ heure avec un courant de $10\,\mathrm{[A]}$? ?
| Anode | Cathode |
|---|---|
| $\ce{6 H2O → 4 H3O+ + O2 + 4e-}$ | $\ce{4 H2O + 4e- → 4 OH- + 2 H2} $ |