Chimie Organique
Les propriétés des molécules organiques se manifestent souvent de manière spectaculaire à notre échelle : l’odeur d’un fruit, l’efficacité d’un médicament ou encore la souplesse d’un plastique découlent directement de la structure de ces molécules. Une infime variation dans la forme d’une molécule — ou dans la position d’un groupe fonctionnel — peut suffire à modifier une odeur agréable en une odeur désagréable, ou à rendre un principe actif inactif. Ce chapitre introduit les fondements de la chimie organique : il permettra de comprendre comment la structure dans l’espace, la présence de fonctions chimiques et l’organisation des atomes (isomérie) expliquent ces effets observables dans la vie quotidienne.
Introduction
Traditionnellement, la chimie est divisée en deux grandes catégories que sont la chimie minérale et la chimie organique. Étymologiquement, la chimie minérale étudie les substances provenant du monde inanimé et la chimie organique, celles qui proviennent des organismes vivants.
L'homme utilisait et utilise encore de nombreux mélanges de substances organiques naturelles comme les parfums, certains médicaments, des essences, du bitume. Mais dès la fin du XIème siècle, il commence à isoler des corps purs :
| XI ème siècle : | éthanol (alcool issu de la fermentation) |
| en 1747 : | saccharose (sucre de betterave) |
| en 1773 : | urée |
Cette distinction était imprégnée d'idées philosophiques, puisque, jusqu'en 1842, date à laquelle Friedrich Wöhler synthétisa l'urée, de nombreux chimistes pensaient que seuls les êtres vivants étaient capables de produire des molécules organiques grâce à une force vitale inaccessible à la science. Aujourd'hui, le terme de chimie organique signifie chimie des composés du carbone à l’exception de ses oxydes ($\ce{CO}$ et $\ce{CO2}$), de l’acide carbonique ($\ce{H2CO3}$), des carbonates ($\ce{CO3^2-}$ ), des cyanures ($\ce{CN-}$) et des carbures ($\ce{C2^2-}$). La chimie des substances du monde vivant s'appelant, plus spécifiquement, chimie biologique ou biochimie.
Depuis cette date l'homme a synthétisé des millions de molécules organiques, les unes, identiques à celles que l'on trouve dans la nature, d'autres n'ayant rien à voir avec le monde vivant. Nombre de composés connus :
| - en 1880, 12’000 | - en 1910, 150’000 |
| - en 1940, 500’000 | - en 1960, 1’000’000 |
| - en 2011, 54’000’000 |
Les molécules organiques ont diverses applications dans la vie courante, par exemple :
| en 1929, Sagex (polystyrène expansé) | en 1938, Teflon | en 1939, DDT (insecticide) |
| en 1940, Nylon | en 1966, Insuline | en 2016, machines moléculaires (Prix Nobel en 2016) |
| en 2021, ronapreve (Covid) | etc. |
La plus petite molécule organique est le méthane CH4 et les plus grosses des polymères comme les protéines de poids moléculaire largement supérieur à 1000. Les composés organiques contiennent, en général, de nombreux atomes de carbone, ces derniers étant liés entre eux et formant de longues chaînes, parfois ramifiées. Cette particularité est typique de l'élément carbone ; elle n'est que partiellement partagée par le silicium. C'est ainsi que toute forme de vie qui a pu apparaître dans l'univers ne peut être basée que sur des composés carbonés, qui seuls peuvent procurer une telle diversité de molécules.
Distinctions entre composés minéraux et organiques
| Composés minéraux | Composés organiques |
|---|---|
| Ils ne contiennent pas de carbone, à l’exception de ses oxydes ($\ce{CO}$ et $\ce{CO2}$), de l’acide carbonique ($\ce{H2CO3}$), des carbonates (($\ce{CO3^2-}$, des cyanures (($\ce{CN-}$) et des carbures ($\ce{C2^2-}$) | Ils sont surtout constitués de carbone, hydrogène, oxygène et peuvent contenir d'autres éléments comme l'azote, le soufre, le phosphore, etc. |
| Formés de liaisons ioniques ou à caractère ionique marqué | Formés de liaisons covalentes. |
| Solubles dans l'eau | Rarement solubles dans l'eau. |
| Très stables thermiquement | Facilement décomposés par la chaleur |
| Rarement combustibles | Presque tous combustibles |
Cycle du carbone
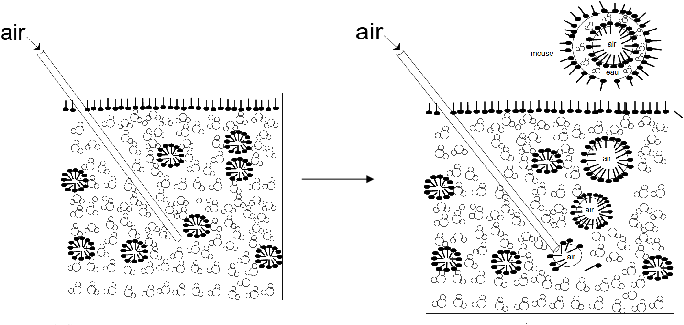
Le cycle du carbone illustre les nombreux échanges de carbone entre les sphères vivantes (biosphère) et non vivantes (atmosphère, hydrosphère, lithosphère). Le carbone y circule sous différentes formes chimiques, comme le dioxyde de carbone ($\ce{CO2}$), les hydrocarbures ou la matière organique. Photosynthèse, respiration, combustion ou décomposition sont autant de processus qui transforment les composés du carbone et les déplacent d’un réservoir à l’autre. Comprendre ces échanges permet de relier des phénomènes globaux comme le changement climatique à la structure et la transformation des molécules carbonées.
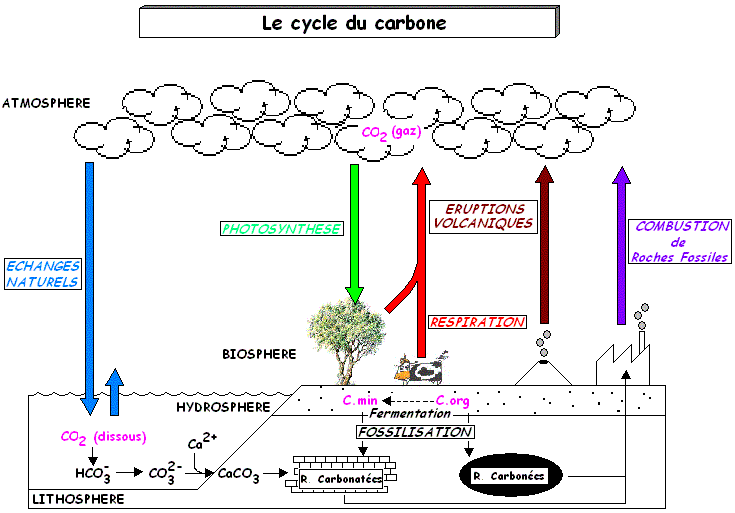
Le cycle du carbone
http://abdelkader.saim.free.fr/2nde/P1C3/schema_cycle_carbone_correction.GIF
Molécules organiques
Les liaisons et la stabilité d'une molécule organique
Le carbone a quatre célibataires et fera donc quatre liaisons dans une molécule la plupart du temps.
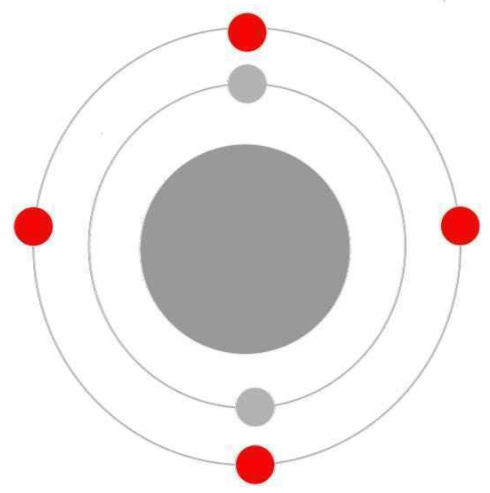
La structure électronique du carbone
Si la chaîne contient uniquement des atomes de carbone, on utilise les noms:
| ALCANES | ALCENES | ALCYNES |
|---|---|---|
| Liaison-s simple-s |
Liaison-s double-s |
Liaison-s triple-s |
La liaison entre le carbone et l’oxygène est une covalence polaire, car l’électronégativité de l’oxygène est de $3,4$ et du carbone de $2,5$, et donc la différence d’électronégativité est de $0,9$.
Dans les molécules, la règle de l’octet est la plupart du temps respectée et favorisera certaine forme de la molécule.
La règle de l'octet est une règle chimique simple qui énonce que les atomes tendent à se combiner de façon à avoir $8$ électrons sur la couche externe (exception : hydrogène $2$ électrons), ce qui leur donne la même structure électronique qu'un gaz noble (couche pleine).
Comment vérifier la règle de l’octet ?
Chaque paire et chaque liaison comptent pour deux électrons.
Fonctions organiques
Les fonctions organiques, aussi appelées groupes fonctionnels, sont des groupes d’atomes responsables des propriétés chimiques caractéristiques d’une molécule. Elles déterminent son comportement, sa réactivité, son solubilité, ou encore son rôle biologique. Être capable de reconnaître une fonction comme un alcool, un acide carboxylique ou une cétone permet de prédire les transformations que la molécule peut subir.
L’extrait des Tables CRM présenté ci-dessous fournit une vue d’ensemble des principales fonctions organiques rencontrées en chimie. Il constitue un outil essentiel pour leur identification efficace et rigoureuse.
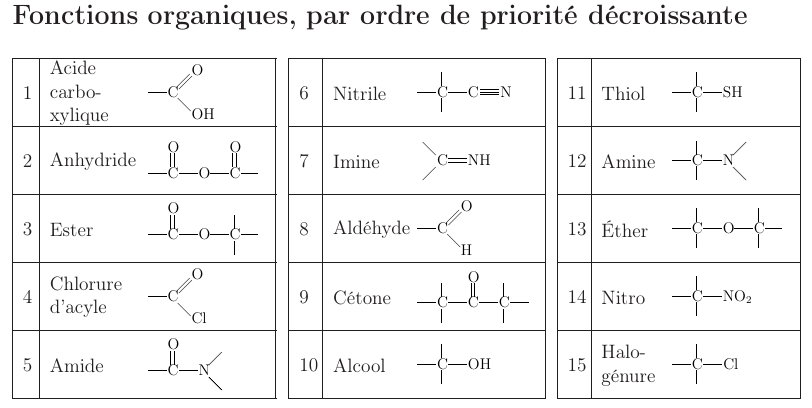
Les fonctions organiques (Tables CRM, page 257)
Comment déterminer la charge formelle sur un atome ?
On détermine la charge formelle d’un atome en calculant le nombre d’électrons de l’élément (une liaison compte pour un électron, car chaque élément met un électron dans la liaison, une paire compte pour deux électrons).
| Nombre d’électron calculé = nombre d’électron de l’atome | charge nulle |
| Nombre d’électron calculé > nombre d’électron de l’atome | charge négative |
| Nombre d’électron calculé < nombre d’électron de l’atome | charge positive |
Exemples :
 |
|---|
L'attribution des charges formelles |
Les critères de stabilité dans l’ordre d’importance
Critère 1
Les formes présentant le nombre maximum d’octets sont avantagées.
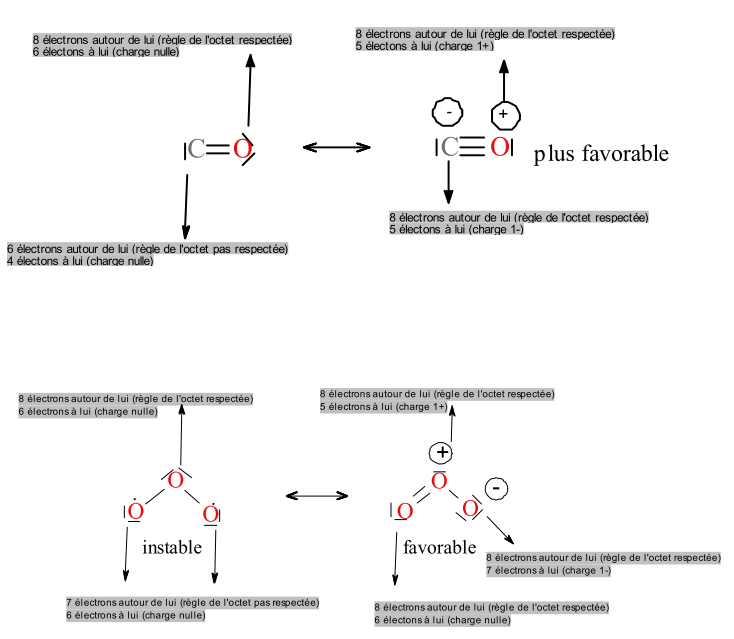
La forme de gauche est la plus stable.
Critère 2
Les charges doivent se situer de préférence sur des atomes en concordance avec leur électronégativité. Exemple : ion énolate.
La forme de gauche est la plus stable.
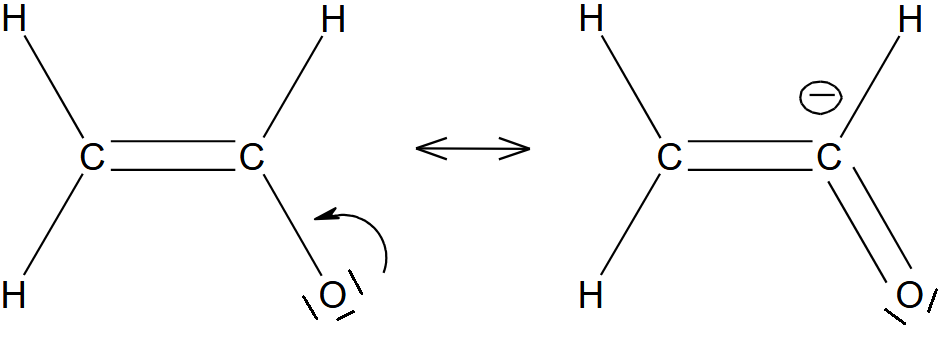
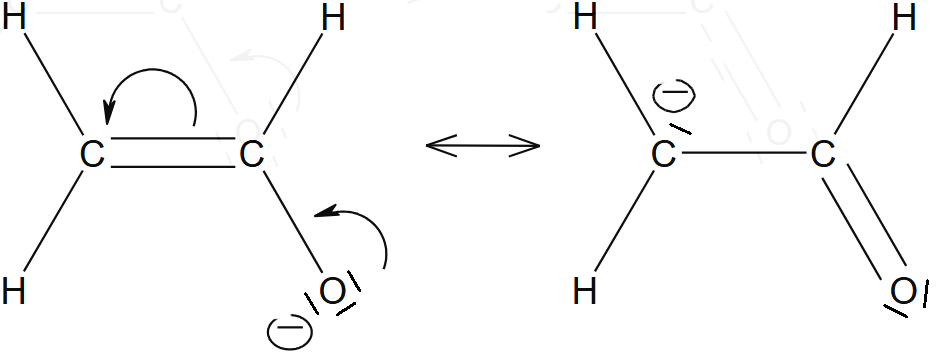
Critère 3
Les formes limites avec le moins possible de séparation de charge seront avantagées
Exemple : acide formique.
La forme de gauche est la plus stable.
Remarque : La séparation de charge peut être encouragée par la règle de l’octet, car il s’agit du premier critère prépondérant. Exemple : Monoxyde de carbone.
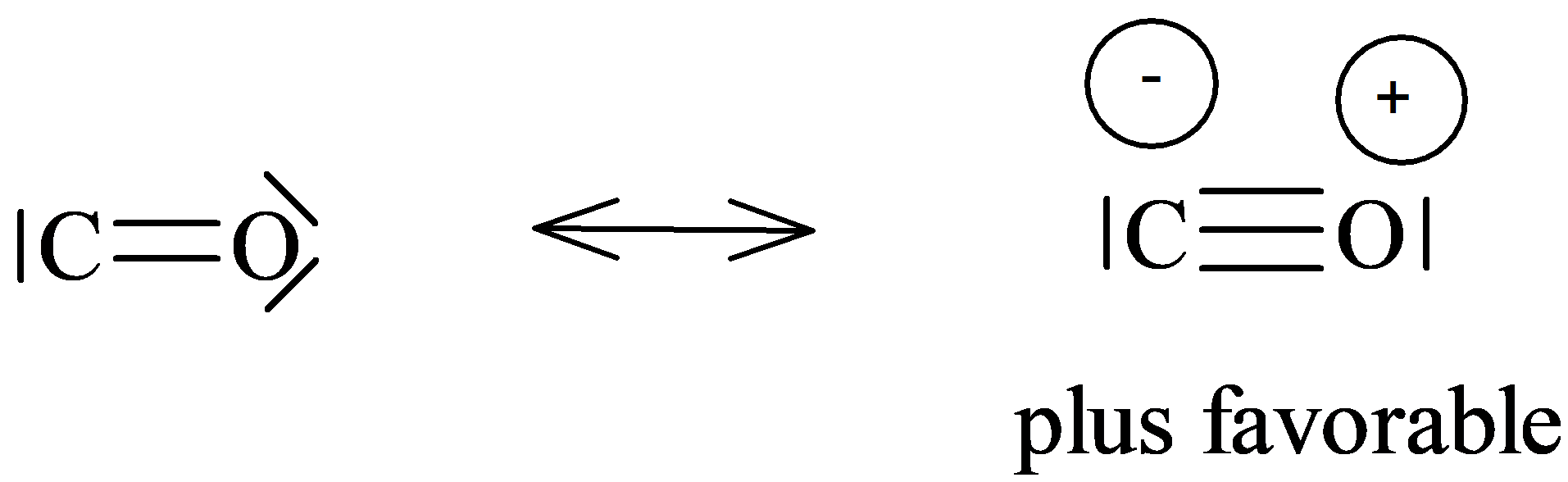
La forme de gauche est la plu stable.
Notation
Il existe plusieurs manières d’écrire les molécules organiques :
| Formule brute | Formule de Lewis (développée) * | Formule semi-développée | Formule topologique |
|---|---|---|---|
| $\ce{C3H8}$ | 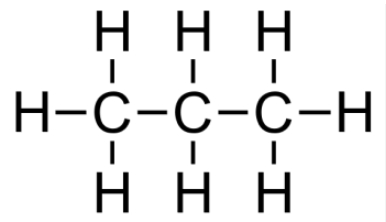 |
$\ce{CH3-CH2-CH3}$ | 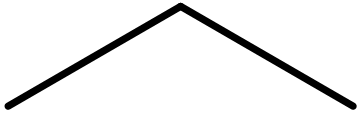 |
*On va considérer ces deux termes (développée et Lewis) comme des synonymes, bien que les tables CRM fassent la différence (Lewis montre les paires d’électrons en plus).
Pour des raisons de simplification, les molécules organiques étant généralement assez imposantes, les chimistes organiciens ont l'habitude d’utiliser la formule topologique qui représente les liaisons C-C par des traits sans montrer les liaisons C-H.
Représentation en perspective cavalière ou représentation de CRAM.
Il est possible de tenir compte de l’orientation dans l’espace de la molécule dans les formules développées (de Lewis), semi-développées ou topologiques. Afin de représenter une liaison:
| qui se trouve dans le plan de la feuille, le trait plein est utilisé |  |
| qui sort du plan de la feuille dans la direction du lecteur, le trait s’épaississant |  |
| qui sort du plan de la feuille pour s’éloigner du lecteur, le trait est discontinu | 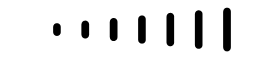 |
Exemple : méthane
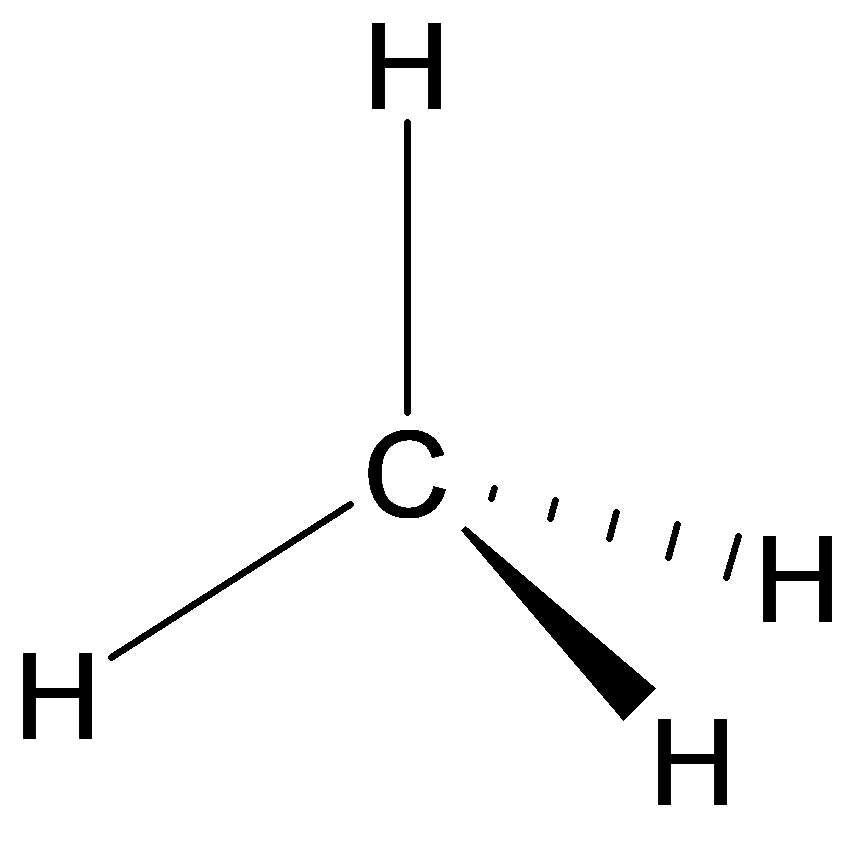
La représentation de Cram du méthane.
- primaire s'il est lié à un atome de carbone. |
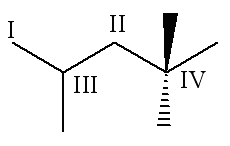 |
Isomérie
On appelle isomères des molécules différentes, mais ayant la même formule brute.
Nous ne verrons que les trois types d’isomérie de constitution :
| Isomérie de Position | Isomérie de Chaîne | Isomérie de Fonction |
|---|---|---|
| La position d’une liaison ou d’une fonction est différente. | L’enchaînement des atomes est différent. | La fonction organique est différente. |
 |
 |
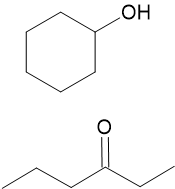 |
Isomères de constitution |
Comment déterminer la formule brute à partir d'une formule topologique ?
-
On compte le nombre de carbones.
-
On applique la formule $\ce{C_{n}H_{2n{}+2}}$, valable pour les alcanes.
-
On compte le nombre d'insaturations (nombre de double/triple liaisons, cycles) et on soustrait deux hydrogènes pour chaque insaturation.
-
On compte les éléments restants (ex. $\ce{O}$, $\ce{F}$ etc) que l'on rajoute dans la formule brute. Ensuite ...
-
pour chaque élément de la 17ème colonne (halogènes), on enlève un $\ce{H}$.
-
pour chaque élément de la 15ème colonne, on rajoute un $\ce{H}$.
Mécanismes réactionnels
Définitions
Mécanisme : le mécanisme explique la rupture et la formation des liaisons en montrant les différentes étapes de la réaction. Schéma d’un mécanisme :
Réactifs → État de transition → etc. → Produits
Réactifs : les substances de départ allant réagir. Le substrat (un des réactifs) est la molécule que l'on souhaite transformer.
Produits : les substances obtenues après la réaction
État de transition : un état instable par lequel les réactifs doivent passer pour que la réaction ait lieu.
La rupture hétérolytique d’une liaison transfère les 2 électrons de la liaison vers un des deux atomes. Il en résulte des cations et des anions.
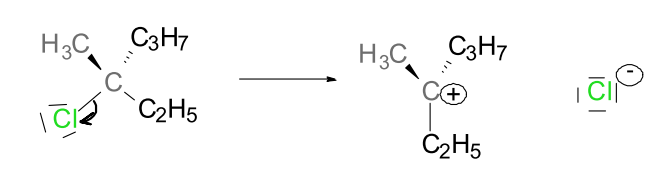
Formations d'ions, après rupture hétérolytique.
La flèche dans un mécanisme réactionnel indique les paires d’électrons utilisées pour former ou casser une liaison.
La rupture homolytique d’une liaison transfère un électron vers chacun des deux atomes. Il en résulte des fragments avec des électrons célibataires (radicaux).
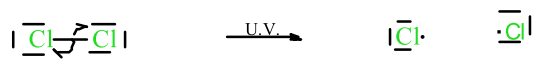
Formations de radicaux, après rupture homolytique.
La demi-flèche dans un mécanisme réactionnel radicalaire indique l’électron utilisé pour former ou casser une liaison.
Un électrophile est déficient en électrons. Il est caractérisé par sa capacité à former une liaison avec une autre substance en acceptant une paire d’électrons.
Exemples : $\ce{H+}$, $\ce{Ca^2+}$, $\ce{AlCl3}$
Un nucléophile réagit en donnant une paire d’électrons à des substances électrophiles pour former une liaison chimique.
Exemples : $\ce{Cl-}$, $\ce{NH3}$, $\ce{H2O}$
Types de réaction
On peut diviser les réactions entre quatre grands groupes :
Substitution
Un atome ou un groupe d'atomes (le substituant) en remplace un autre dans une molécule.
Par exemples la chloration du méthane ou du la bromation du benzène.
$\ce{CH4 + Cl2 -> CH3Cl + HCl}$
$\ce{C6H6 + Br2 -> C6H5Br + HBr}$
Addition
Les fragments d'une molécule se fixent sur deux atomes d'une autre molécule. Cette addition nécessite la présence d'une double liaison. Par exemple, l'addition d'eau sur l'éthène.
$\ce{CH2 = CH2 + H2O -> CH3CH2OH}$
Élimination
C'est l'inverse d'une addition. Deux fragments d'une molécule étant arrachés. Par exemple :
$\ce{CH3CH2OH -> CH3CHO + H2}$
$\ce{CH3CH2Cl + NaOH -> CH2 = CH2 + NaCl + H2O}$
Réarrangement
Certains atomes d'une molécule changent de place. Par exemple, l'énolisation d'un aldéhyde.
$\ce{CH3 – CH = O -> CH2 = CHOH}$
Solubilité
Les molécules organiques sont la plupart apolaire et donc peu soluble dans l’eau , molécule polaire.
Elles ne sont pas compatibles (polaire et apolaire) ou sont dits non miscibles.
On dit pour mettre en évidence la propriété que les molécules semblables sont miscibles:
"Like dissolves like"
Cependant, certaines molécules organiques grâce à la liaison hydrogène ou l’aide de savon sont plus solubles (se dispersent) dans l’eau.
Liaison hydrogène
L'eau, bien qu'étant une petite molécule a un point d'ébullition élevé. Ceci est dû à des liaisons intermoléculaires, appelées liaisons ou ponts hydrogène.
Les alcools, portant comme l'eau le groupe $\ce{-OH}$, auront des propriétés semblables à celles de l'eau. Les petites molécules d'alcools sont d'ailleurs miscibles à l'eau en toutes proportions.
Les liaisons hydrogène peuvent se produire entre molécules d'eau et d'alcool.
Ceci s'explique, d'une part, par la relativement grande différence d'électronégativité entre l'hydrogène et l'oxygène ($ΔE = 1,2$) et, d'autre part, par la présence de deux paires d'électrons sur l'oxygène. Une attraction électrostatique s'exerce entre molécules d'eau, entre molécules d'alcool et entre molécules d'eau et d'alcool.
| Eau | Ethanol | |
|---|---|---|
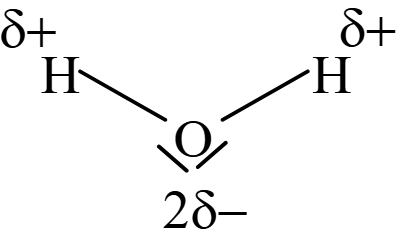 |
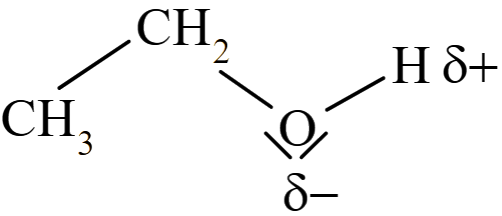 |
Dans un mélange d'eau et d'alcool, on aura la situation suivante:
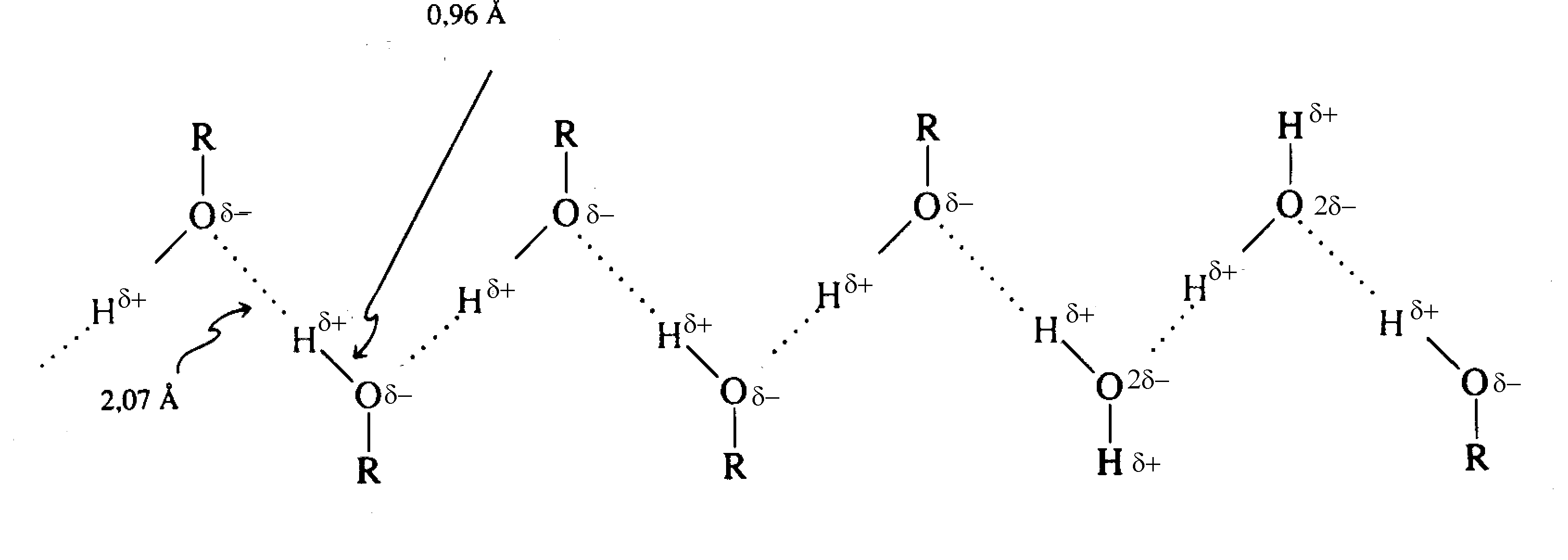
Liaisons hydrogène entre des molécules d'eau et d'alcool.
Plus la partie hydrocarbonée (liposoluble) de l'alcool est importante, moins l'alcool sera soluble dans l'eau. Seule l'extrémité pouvant faire des liaisons hydrogène est soluble. Cette règle générale peut être appliquée à tous les exemples de solubilité (dérivés chlorés, éthers, etc.)
Les savons
Le savon a la propriété de disperser des molécules organiques, notamment la graisse, dans l’eau.
Les savons sont connus depuis plus de $2000$ ans, mais ce n’est qu’au XIXème siècle qu’ils sont fabriqués industriellement. On en produit plus de 6 millions de tonnes par an, y compris les détergents. Le savon est le produit de l’hydrolyse alcaline d’une graisse animale ou végétale (triester). Cette réaction s’appelle la saponification (du latin sapo, savon).
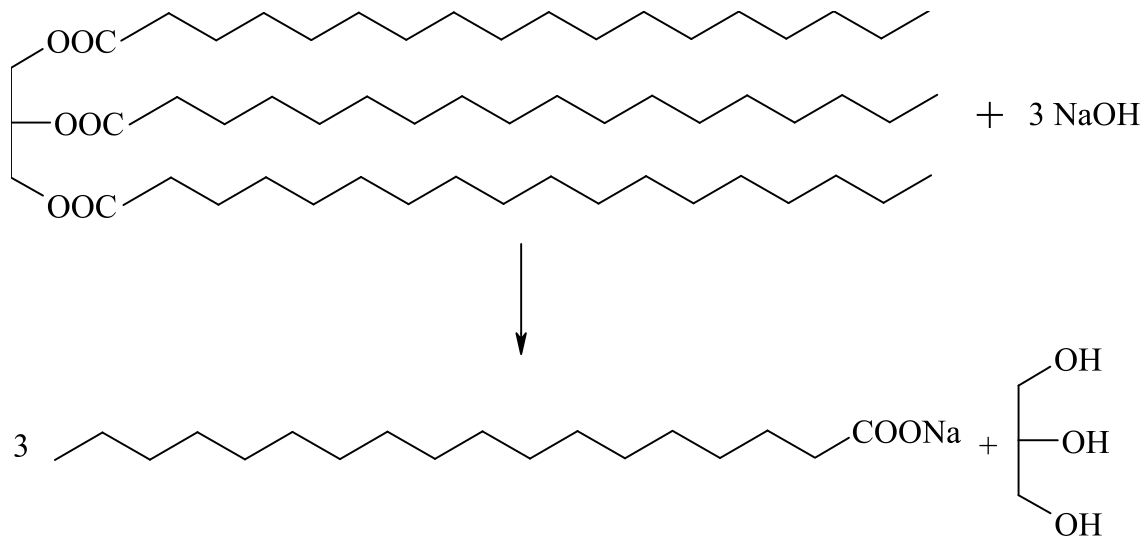 |
|---|
La réaction de saponification |
Exemple :
Le savon est donc un sel d’acide gras, contenant une vingtaine d’atomes de carbone.
Sa formule pourrait être :
| $\ce{CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2COO^{–} \quad Na+}$ |
 |
La structure moléculaire du savon |
Un savon est basique.
Le savon: et oui, ça lave, mais comment ? |
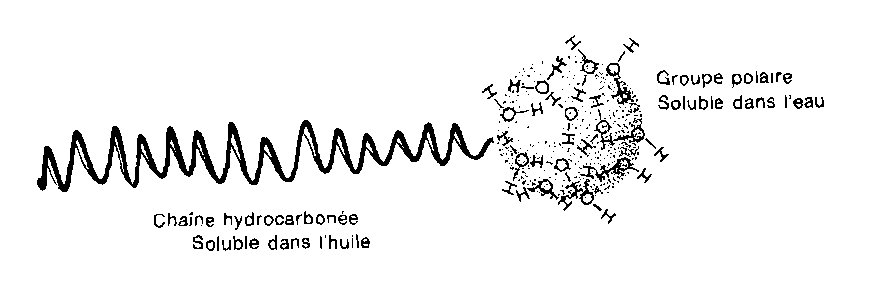 |
Le pouvoir détergent du savon est dû au fait qu’il est constitué d’une longue chaîne hydrocarbonée attirée et soluble dans les corps gras (lipophile) et d’une extrémité ionique attirée et soluble dans l’eau (hydrophile)
Comportement du savon dans l’eau
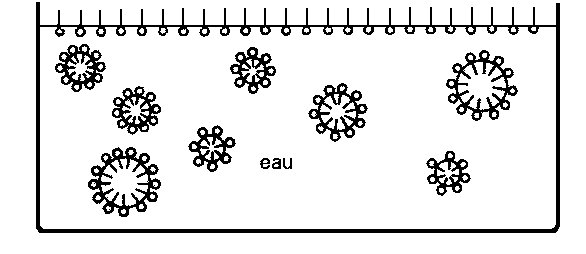
Formation de micelles
En surface, la partie ionique est dans l’eau et la partie hydrocarbonée en dehors. Le savon s’étale en surface en couche monomoléculaire. Dans l’eau, il forme des micelles dans lesquelles la partie ionique est à l’extérieur et la partie hydrocarbonée à l’intérieur emprisonnant la graisse si l’eau en contenait. On peut ainsi dire que le savon dissout ou, plutôt, disperse la graisse dans l’eau. Ces micelles étant relativement grosses, l’eau savonneuse apparaît trouble.
Série d'exercices - Chimie Organique
Placez les réactions simplifiées suivantes sur le cycle du carbone ci-dessous :
$\ce{CO2 + H2O -> HCO3- + H+}$
$\ce{Ca^{2+} + HCO3^{-} -> Ca^{2+} + CO3^{2-} + H+ -> CaCO3 + H+}$
$\ce{6 CO2 + 6 H2O -> C6H12O6 + 6 O2}$
$\ce{C6H12O6 + 6 O2 -> 6 CO2 + 6 H2O}$
$\ce{C6H12O6 -> 2 CH3CH2OH + 2 H2O + 2 CO2}$
$\ce{2 C8H18 + 25 O2 -> 16 CO2 + 18 H2O}$
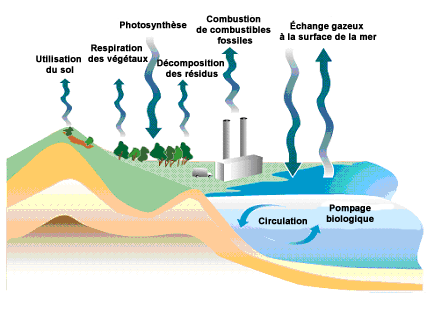
Le cycle du carbone
Composition du pétrole. Donnez les formules semi-développées, brutes et topologiques des molécules donnés ci-dessus. Le pétrole est un mélange de molécules organiques qui peuvent être :
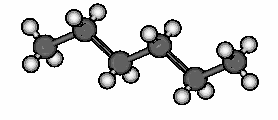 en chaîne linéaire |
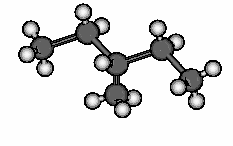 en chaîne linéaire |
 en cycle |
 cycle aromatique |
 chaîne sulfurée |
Des exemples de molécules organiques possédant des structures différentes. |
Donnez les formules brute, semi-développée et de Lewis de la molécule suivante :
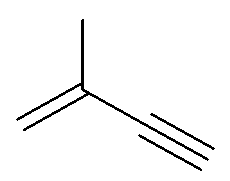 |
Donnez la formule brute de la molécule suivante :
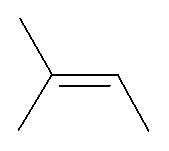 |
Soit la molécule suivante : $\ce{H2C=CH-C#CH}$. Dessinez la molécule en formule topologique et en formule développée, en utilisant Cram si nécessaire.
Les principales fonctions organiques. Voici trois exemples de groupes fonctionnels (alcool, amine, acide carboxylique) fréquemment présents dans les molécules organiques :
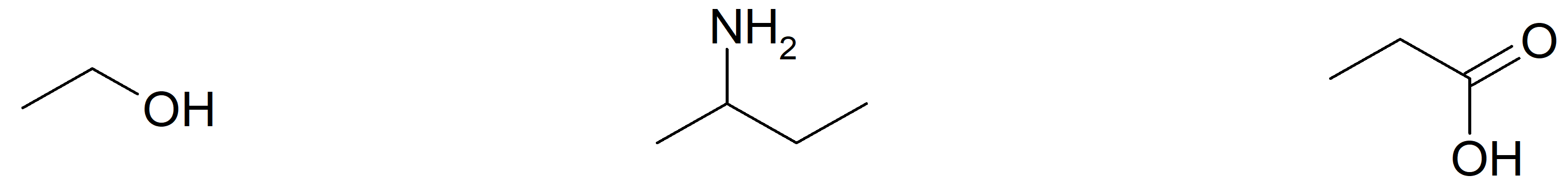
Donnez les représentations de Cram de ces trois molécules.
La molécule ci-dessous a deux fonctions. Lesquelles ?
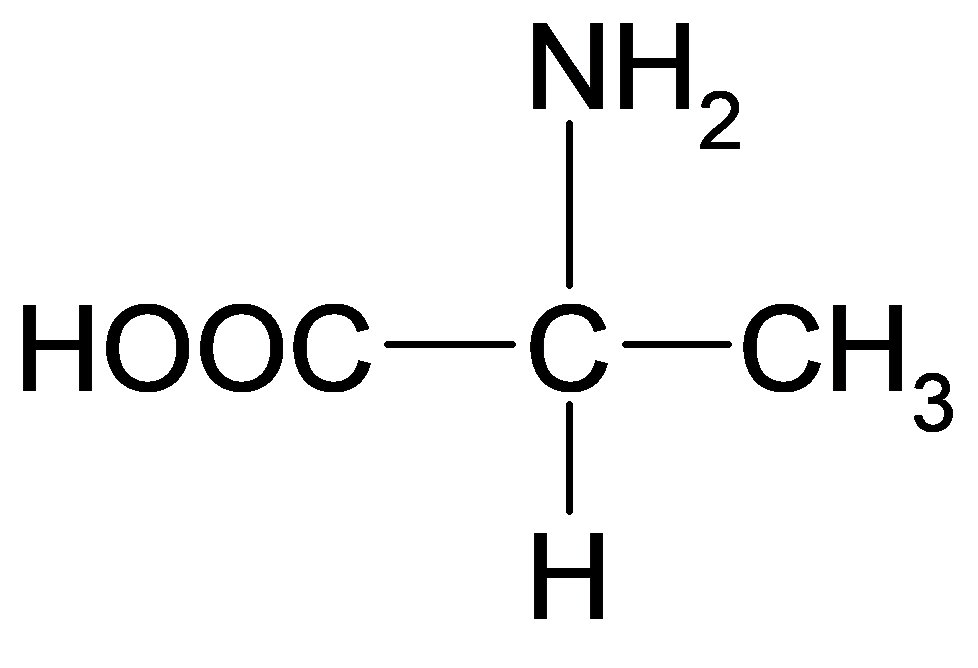 |
Comment sont appelées les molécules avec ces deux fonctions ?
Donnez la formule bâtonnet de l’acide acétique représenté ci-dessous contenu dans le vinaigre.
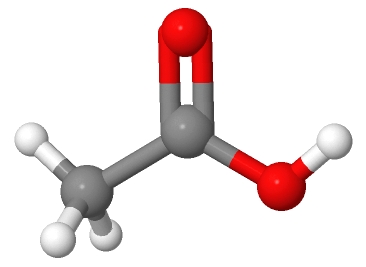 |
Donnez la formule brute de l’acide oléique présent dans les graisses. Voici l'exemple de l'acide oléique.
 |
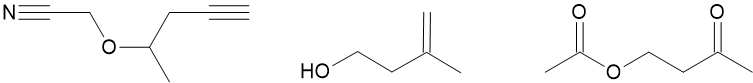
Pour les trois molécules ci-dessous, donnez d’abord la formule brute, puis déterminez le nombre de groupes fonctionnels contenus dans la molécule et nommez-les.
Donnez le nombre de paires et de célibataires à l’aide de la représentation de Lewis sur la couche externe de l’atome chlore $\ce{Cl}$, de l’anion $\ce{Cl-}$ et du cation $\ce{Cl+}$.
Y a-t–il un électrophile parmi ces substances ?
Soit les substances :
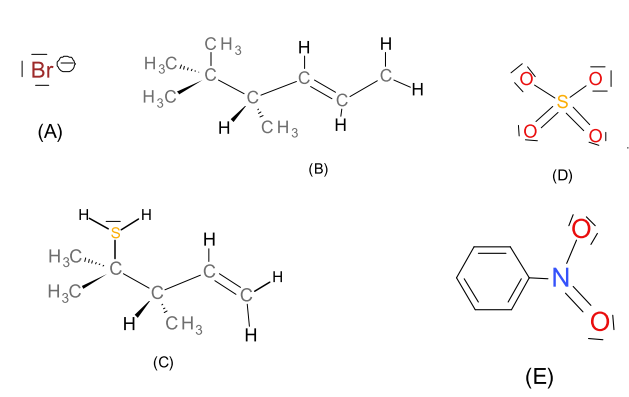
Ajoutez ou modifiez les charges des substances ci-dessous, s’il y a des erreurs. Indication : toutes les paires d’électrons et les atomes d’hydrogène présents figurent dans les formules de Lewis des composés.
Les substances (A) et (B) sont-elles des nucléophiles ou des électrophiles ? Expliquez.
Donnez la formule de Lewis de ces substances ci-dessous. Lesquelles sont nucléophiles ? Lesquelles sont des électrophiles ?
$$ \ce{H2O}\quad \ce{CN^{–}}\quad \ce{Br+}\quad \ce{ OH^{–}}\quad \ce{NH3} $$
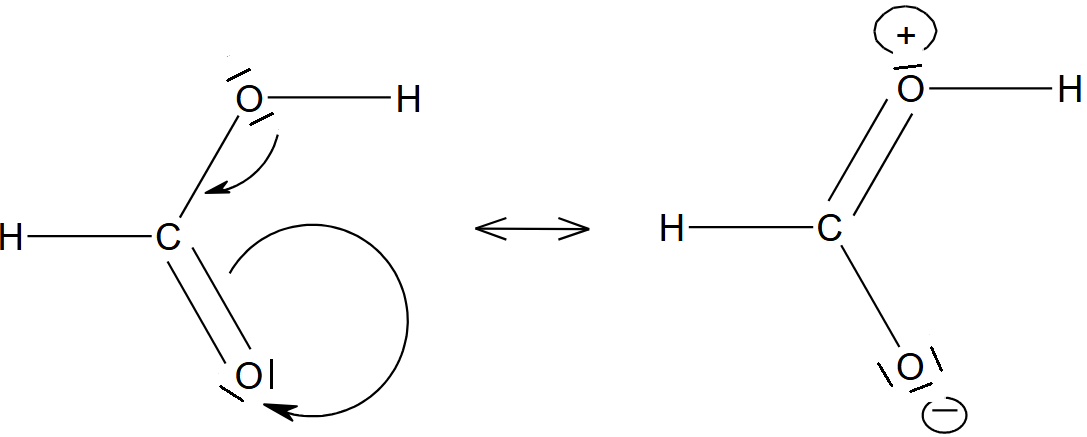
Complétez le mécanisme avec les flèches et les charges manquantes permettant de comprendre le déroulement de la réaction. il s'agit du mécanisme de l’addition sur un groupe carbonyle par attaque électrophile (catalyse acide).
Protonation du groupe carbonyle
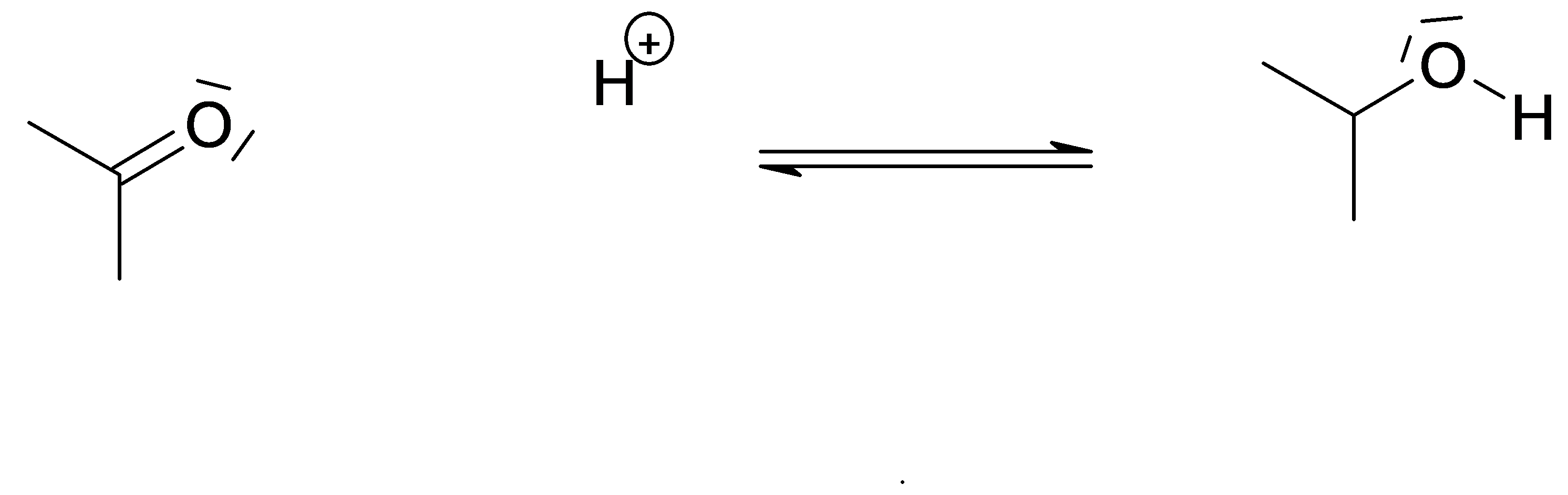
Piégeage par l’eau (nucléophile)
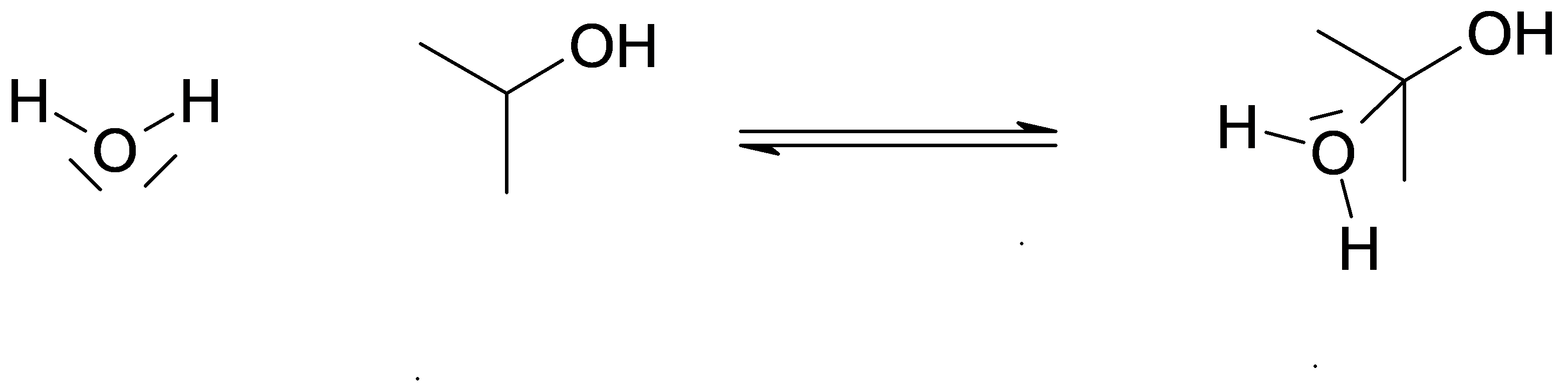
Déprotonation et formation du diol
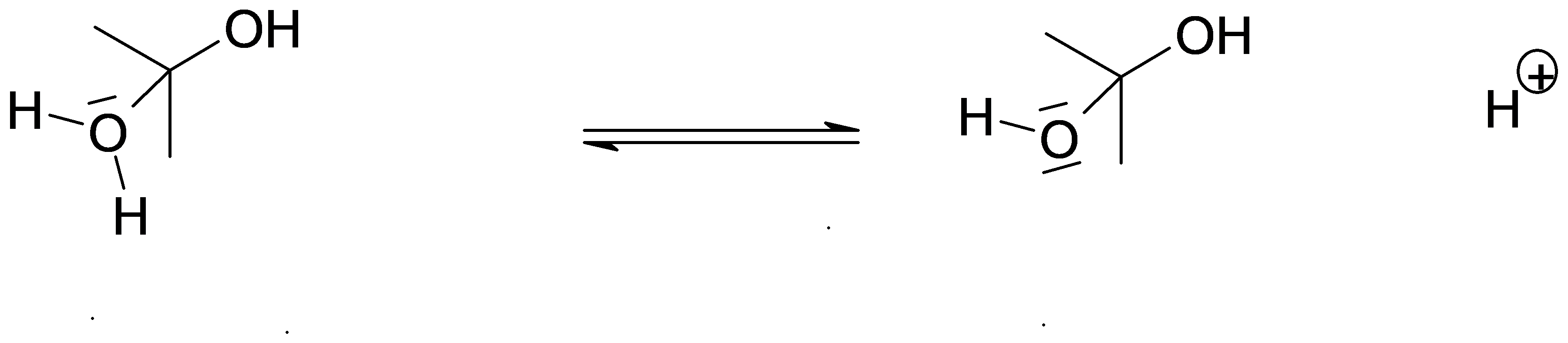
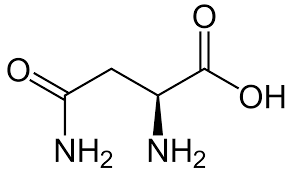
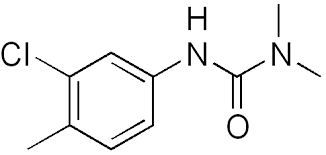
A partir des formules topologiques ci-dessous, donnez la formule brute de:
 |
 |
|---|---|
Asparagine (acide aminé) |
Chlortorulon (herbicide) |
À partir de la formule brute $\ce{C6H10O2}$ , donnez deux isomères de position, deux isomères de chaîne et deux isomères de fonction.
Complétez le mécanisme avec les flèches et les charges manquantes permettant de comprendre le déroulement de la réaction. Il s'agit du mécanisme de l’addition sur un groupe carbonyle par attaque nucléophile (catalyse basique).
Attaque par le nucléophile du groupe carbonyle
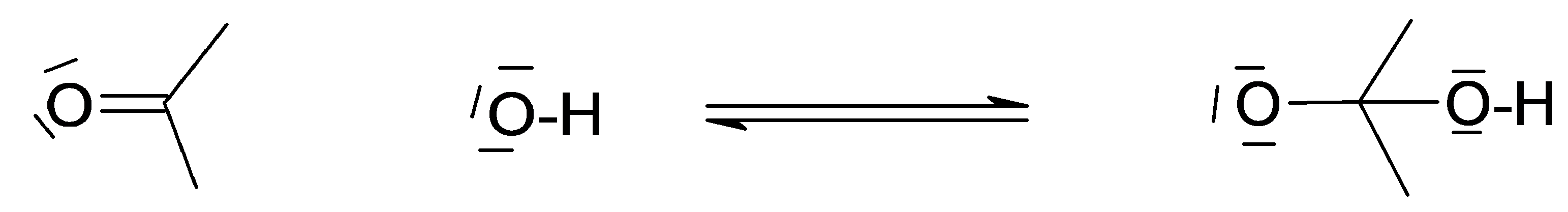
Protonation et formation du diol
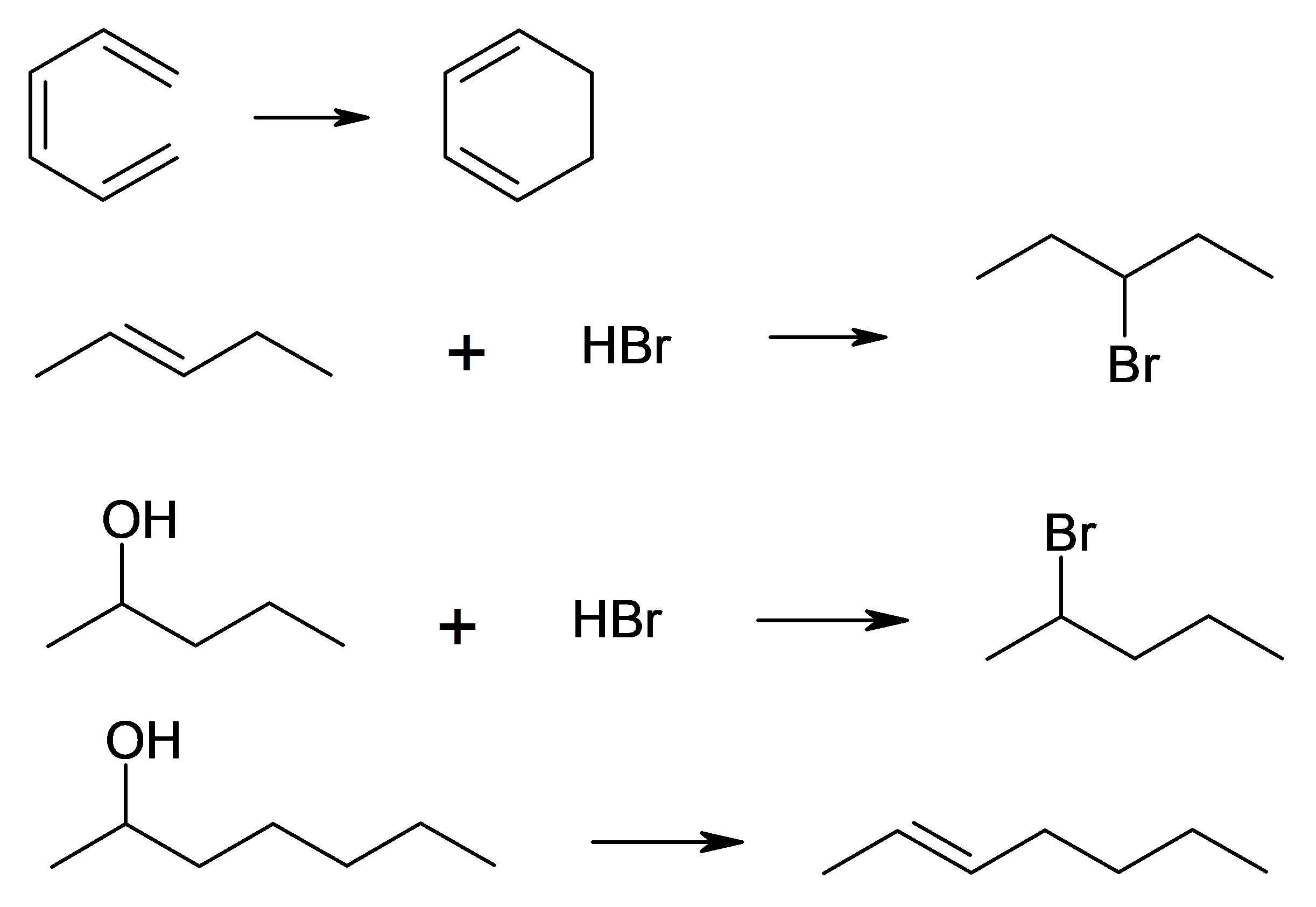
Indiquez pour chacune des réactions suivantes s’il s’agit d’une réaction de substitution, d’addition, d’élimination ou de réarrangement.
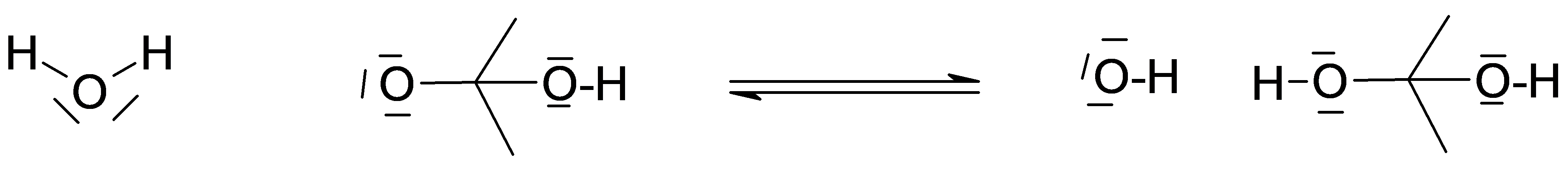
Pour le situations suivantes:
Écrivez les ruptures hétérolytiques du $\ce{KI}$, du $\ce{LiOH}$, et de
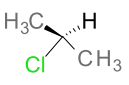
Écrivez les ruptures homolytiques de la molécule $\ce{H2}$.
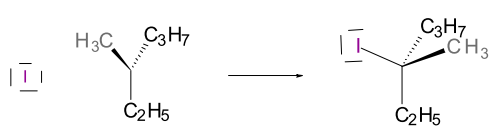
Complétez le mécanisme avec les flèches, les charges et les substances manquantes permettant de comprendre le déroulement de la réaction.
$\ce{NaI → Na+ + ………..}$
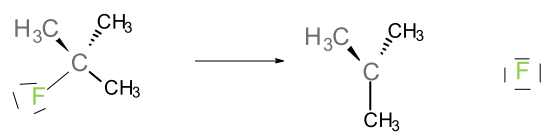 $\qquad$
$\qquad$
 $\qquad$
$\qquad$
Déterminez les isomères à partir de la formule brute $\ce{C4H8}$.
Soit la formule $\ce{C4H8O}$, donnez la formule d’une cétone, d’aldéhyde, d’un alcool et d’un éther. Comment nomme-t-on le type d’isomérie qui met en relation ces quatre molécules ?
Expliquez le mélange entre l’huile et l’eau. Croquis (les proportions des tailles de l’eau, de l’huile et du savon ne sont pas respectées).

Expliquez l’effet du savon sur un mélange entre l’huile et l’eau.

Expliquez le mélange entre le savon et l’eau.

Dessinez toutes les liaisons hydrogène qu'une molécule de méthanol peut établir avec l'eau ?