Réactions d'oxydoréduction
Nous travaillerons les réactions chimiques au cours desquelles un échange d’électrons se produit. Qui dit échange d'électrons, dit courant électrique. Parvenir à exploiter ces électrons est donc le point de départ pour faire fonctionner un dispositif électrique, comme la batterie d'un téléphone portable.
Rappel sur les nombres d'oxydation (n.o.)
Le nombre d'oxydation d'un atome indique le nombre d'électrons échangés lors de la formation d'une liaison chimique. Il exprime l'état d'oxydation d'un atome, soit le nombre de charges gagnées (n.o. -) ou perdues (n.o. +).
Nombre d'oxydation des éléments
Plus de la moitié des éléments ont plusieurs états d'oxydation possibles. Par exemple le chlore $\ce{Cl}$:
| Composé | Nombre d'oxydation du $\ce{Cl}$ |
|---|---|
| $\ce{NaCl}$ | $-1$ |
| $\ce{Cl2}$ | $0$ |
| $\ce{NaClO}$ | $+1$ |
| $\ce{NaClO2}$ | $+3$ |
| $\ce{NaClO3}$ | $+5$ |
| $\ce{NaClO4}$ | $+7$ |
-
Dans une molécule la somme des n.o. = $0$
-
Les atomes non liés (atome élémentaire) ou liés par covalence pure : n.o. = $0$. Exemples:
- Atomes non liés : $\ce{Fe}$, $\ce{Cu}$, $\ce{Na}$, $\ce{P}$ etc...
- Atomes liés par covalence pure : $\ce{Cl2}$, $\ce{N2}$, $\ce{O2}$ etc...
- Oxygène : ($2-$) dans tous les cas [sauf composé avec $\ce{F}$, exemple $\ce{OF2}$ ($2+$)]
- Métaux : Colonne 1A ----> ($1+$) Colonne 2A ----> ($2+$)
- E. de transition : toujours positif, à calculer depuis la formule développée du composé.
- Non-métaux : négatif si liés à un métal ou $\ce{H}$, positif si lié à l'oxygène.
Les réactions d'oxydoréduction
Réactions qui sont, dans la pratique, les plus importantes :
-
La combustion (oxydation rapide).
-
La respiration (oxydation en présence d'oxygène).
-
La corrosion (oxydation lente).
Définition élémentaire
Oxydation vient d'oxygène, c'est donc la fixation d'oxygène.
Expérience 1 : oxydation (combustion) du magnésium par l'oxygène de l'air.
Équation :
| $\ce{Mg}$ (réactif) | n.o. = .................... | $\ce{Mg}$ (produit) | n.o. = .................... |
| $\ce{O}$ (réactif) | n.o. = .................... | $\ce{O}$ (produit) | n.o. = .................... |
Réduction : O s'est réduit, son nombre d'oxydation a diminué.
Oxydation : Mg s'est oxydé, son nombre d'oxydation a augmenté.
La perte d'électrons par un atome doit être accompagnée d'un gain d'électrons par un autre atome. En fait, les électrons gagnés par l'élément réduit sont ceux perdus par l'élément oxydé, il y a donc toujours simultanément une oxydation et une réduction. Il s'agit d'une réaction d'oxydoréduction. Les termes d'oxydation et de réduction sont généralisés pour toutes les réactions équivalentes même en l'absence d'oxygène.
Définition générale
Expérience 2 : réaction du zinc et de l'acide chlorhydrique. Équation :
| $\ce{Zn}$ (réactif) | n.o. = .................... | $\ce{Zn}$ (produit) | n.o. = .................... |
| $\ce{H}$ (réactif) | n.o. = .................... | $\ce{H}$ (produit) | n.o. = .................... |
Oxydation : perte par un atome ou un ion d'un ou plusieurs électrons.
Réduction : gain par un atome ou un ion d'un ou plusieurs électrons.
Il n'y a pas d'électrons qui s'échappent ... Par conséquent, on conclut que:
nombre total d'électrons perdus = nombre total d'électrons gagnés
Autres définitions importantes:
Oxydant: c'est la particule qui se réduit (en se réduisant, elle capte des électrons provenant d'une particule, qui, à son tour, s'oxyde). Par conséquent, la particule qui se réduit, oxyde une autre particule: elle est donc un oxydant.
Réducteur: c'est la particule qui s'oxyde (en s'oxydant, elle perd des électrons, captés par une particule, qui, à son tour, se réduit). Par conséquent, la particule qui s'oxyde, réduit une autre particule: elle est donc un réducteur.
Une réaction d'oxydoréduction est donc une réaction au cours de laquelle il y a échange d'électrons. Un des atomes cédera ses électrons au profit d'un second qui les captera. Au cours d'une telle réaction, le n.o. des éléments concernés est modifié.
Couples ox/red
A toute forme oxydée correspond une forme réduite. Ces systèmes portent le nom de couple ox / red (forme oxydée / forme réduite) :
Reprenons l'expérience 2 dont l'équation chimique est: $\ce{Zn + 2 HCl -> ZnCl2 + H2}$
| $\ce{Zn}$ | + | $\ce{2HCl}$ | $\ce{->}$ | $\ce{ZnCl2}$ | + | $\ce{H2}$ |
| forme réduite | forme oxydée | forme oxydée | forme réduite |
Couple ox/red: $\ce{Zn^{2+} / Zn^{0}}$ et $\ce{H+ / H^{0}}$
Equation simplifiée équilibrée
Expérience 3 : oxydation du fer par le cuivre.

On observe un dépôt de …………… métallique (…….) sur le clou ($\ce{Fe^{0}}$). Les ions $\ce{Cu^{2+}}$ gagnent des électrons provenant du clou. Une partie du clou passe en solution sous forme d’ions ……….
| $\ce{Fe}$ (réactif) | n.o. = .................... | $\ce{Fe}$ (produit) | n.o. = .................... |
| $\ce{Cu}$ (réactif) | n.o. = .................... | $\ce{Cu}$ (produit) | n.o. = .................... |
Couple ox/red:
............................................... et ...............................................
Équations partielles et équation simplifiée équilibrée =
\begin{align} \ce{&Cu^2+} + 2\,\text{électrons} \ce{-> Cu^0} \quad\text{réduction} \\ \ce{&Fe^0} - 2\,\text{électrons} \ce{-> Fe^2+} \quad\text{oxydation} \\ \hline \ \ce{&Fe^0 + Cu^2+ -> Fe^2+ + Cu^0} \end{align}
L'équation simplifiée est équilibrée quand:
nombre total d'électrons perdus = nombre total d'électrons gagnés
Il faut parfois utiliser des coefficients pour obtenir cette égalité
Expérience 4 : oxydation du zinc par l'argent.

On observe un dépôt d' …………… métallique (…….) sur la plaque de zinc ($\ce{Zn^{0}}$). Les ions $\ce{Ag^{+}}$ gagnent des électrons provenant du zinc. Une partie du zinc passe en solution sous forme d’ions ……….
| $\ce{Zn}$ (réactif) | n.o. = .................... | $\ce{Zn}$ (produit) | n.o. = .................... |
| $\ce{Ag}$ (réactif) | n.o. = .................... | $\ce{Ag}$ (produit) | n.o. = .................... |
Équations partielles et équation simplifiée équilibrée :
\begin{align} .... (\ce{&Ag^+} + 1\,\text{électron} \ce{-> Ag^0}) \quad\text{réduction} \\ \ce{&Zn^0} - 2\,\text{électrons} \ce{-> Zn^2+} \quad\text{oxydation} \\ \hline \ .... \ce{&Ag^+ + Zn^0 ->} .... \ce{Ag^0 + Zn^2+} \end{align}
Résolution d'une équation ox/red
Exemple : $\ce{KI + NaOCl + H2O -> I2 + NaCl + KOH}$
- Équilibrer électroniquement
même nombre d'électrons perdus et gagnés
a) Rechercher les particules qui ont été oxydées et réduites. Ce sont celles dont le n.o. a changé au cours de la réaction.
$\ce{I}$ est passé de $-1$ dans $\ce{KI}$ à $0$ dans $\ce{I2}$ et $\ce{Cl}$ est passé de $+1$ dans $\ce{NaOCl}$ à $-1$ dans $\ce{NaCl}$
b) Écrire les équations partielles d'oxydation et de réduction et équilibrer l'équation simplifiée des couples (la somme des électrons doit être nulle).
\begin{align} ....\ce{&I^-} -1\,\text{électron} \ce{->I^0}\\ \ce{&Cl^+} +2\,\text{électrons} \ce{-> Cl^-} \\ \hline \ .... \ce{&I^- + Cl^+ ->} ....\ce{ I^0 + Cl^-} \end{align}
c) Introduire les coefficients trouvés dans l'équation (on peut aussi les doubler mais le rapport doit rester le même) en les soulignant. $$ \ce{ 2KI + NaOCl + H2O -> I2 + NaCl + KOH} $$
- Équilibrer les masses
même nb d'atomes de chaque élément dans les 2 membres de l'équation
Il faut équilibrer sans modifier les coefficients soulignés précédemment sauf si nécessaire en les multipliant par un même nombre.
- utiliser les atomes d'oxygène en dernier
\begin{align} \ce{2KI + NaOCl + H2O -> I2 + NaCl +2 KOH} \end{align}
- Vérifier
Contrôler qu'il y a le même nombre d'atomes à gauche et à droite de votre équation.
Réaction de dismutation
C'est une réaction au cours de laquelle un atome donné peut donner lieu à :
- un premier produit où cet atome est oxydé
- un deuxième produit où le même atome est réduit
Exemple : $\ce{Cl2 + NaOH -> NaClO3 + NaCl + H2O}$
Un atome de $\ce{Cl}$ de n.o. = $0$ s'oxyde en $\ce{Cl^5+}$ dans $\ce{NaClO3}$
Un atome de $\ce{Cl}$ de n.o. = $0$ se réduit en $\ce{Cl-}$ dans $\ce{NaCl}$
Résolution :
\begin{align} \ce{&Cl^0} - 5\,\text{électrons} \ce{-> Cl^5+}\\ 5(\ce{&Cl^0} +1\,\text{électron} \ce{-> Cl^-}) \\ \hline \ \ce{6&Cl^0 -> 5Cl^- + Cl^5+} \end{align}
L'on obtient ainsi:
\begin{align} \ce{3Cl2~ + 6NaOH -> NaClO3 + 5NaCl + 3H2O} \end{align}
Exercices SERIE A Réactions d’Oxydoréduction
Établir l'équation simplifiée équilibrée sachant que le $\ce{Mn^7+}$ oxyde le $\ce{Sn^2+}$
$\ce{Ca3(PO4)2 + SiO2 + C -> CaSiO3 + CO + P4}$

Combustion
Les réactions de combustion sont des réactions d’oxydoréduction qui ont lieu entre une substance et l’oxygène $\ce{O2}$. Ces réactions sont pour la plupart exoénergétiques (dégagent de l’énergie). Le terme combustible s’utilise pour tous les corps qui ont la propriété de brûler et qui produisent de l’énergie calorifique par combustion. Le terme comburant s’utilise pour les corps qui, en se combinant à une autre substance, opèrent la combustion de cette dernière. Dans les cas que nous traiterons, le comburant sera toujours l’oxygène $\ce{O2}$.
Nous allons développer ici deux types de combustions, celle qui a lieu entre un élément et de l’oxygène et celle qui a lieu entre un hydrocarbure et de l’oxygène.
Combustion des éléments
Les réactions de combustion qui ont lieu entre un élément et l’oxygène mènent à la formation d’oxydes de l’élément.
Combustion du soufre.
Lors de la combustion du soufre, le dioxyde de soufre est formé. On considère celle-ci comme une combustion incomplète, car le n.o. du soufre n'a pas atteint la valeur maximale permise pour le soufre (= $+6$).
$\ce{ S + O2 -> SO2 }$
| 1x | $\ce{S^0 - 4e^- -> S^4+}$ | oxydation | réducteur : $\ce{S}$ |
| 2x | $\ce{O^0 + 2e^- -> O^2- }$ | réduction | oxydant : $\ce{O2}$ |
Par la suite le trioxyde de soufre peut se former ( $\ce{2S + 3O2 -> 2SO3}$). Celle-ci est bien une combustion complète, car le n.o. du $\ce{S}$ oxydé est = $+6$.
Acidité et basicité des oxydes
Lorsqu’on met un oxyde de métal dans l’eau, un hydroxyde se forme, tandis que lorsqu’on met un oxyde de non-métal dans l’eau, c'est un oxacide qui est crée. Exemples :
-
$\ce{SO2}$ et $\ce{SO3}$ dans l’eau
- $\ce{SO2 + H2O -> H2SO3}$ (acide sulfureux)
- $\ce{SO3 + H2O -> H2SO4}$ (acide sulfurique)
-
$\ce{MgO}$ dans l’eau
- $\ce{MgO + H2O -> Mg(OH)2}$ (hydroxyde de magnésium = base)
oxyde de métal dans l’eau → BASE
oxyde d’un non-métal dans l’eau → ACIDE
La réaction d’un oxyde avec l’eau n’est pas une oxydoréduction (les n.o. ne changent pas lors de cette réaction)
Combustion des hydrocarbures
Les hydrocarbures sont des molécules organiques formées uniquement de carbone et d’hydrogène. Le pétrole est un mélange liquide d’hydrocarbures, mais il existe aussi des hydrocarbures à l’état gazeux par exemple le méthane dans le gaz naturel. Lors de leur combustion complète (quel que soit l’hydrocarbure brûlé), ils produisent toujours du dioxyde de carbone ($\ce{CO2}$) et de l’eau ($\ce{H2O}$). En cas de combustion incomplète (manque d'oxygène), du monoxyde de carbone voire du carbone peuvent remplacer les dioxydes de carbone.
Exemple : Le gaz naturel (majoritairement du méthane $\ce{CH4}$) C'est la deuxième source d'énergie la plus utilisée dans le monde après le pétrole. Sa consommation se développe rapidement. Lorsque l’on brûle le gaz naturel, les réactions suivantes ont lieu :
Combustion complète :
$\ce{CH4 +2 O2 -> 2 H2O + CO2}$
Combustions incomplètes :
$\ce{CH4 + \frac{3}{2} O2 -> 2H2O + CO}$ (gaz toxique)
$\ce{ CH4 + O2 -> 2 H2O + C }$ (suie)

Lorsqu'une chaudière est mal réglée (arrivée d'oxygène insuffisante), il est possible qu'elle produise du monoxyde de carbone au lieu du dioxyde de carbone. Si ce dernier n'est pas toxique, le $\ce{CO}$, un gaz incolore et inodore, est capable de se lier aux molécules d'hémoglobine chargées de transporter l'oxygène dans le sang. Cette réaction étant quasiment irréversible, contrairement à celle qu'effectue l'hémoglobine avec l'oxygène (ce qui lui permet par ailleurs de relâcher l'oxygène dans les tissus qui en ont besoin), les molécules d'hémoglobine liées au $\ce{CO}$ ne peuvent plus le relâcher et deviennent donc inaptes au transport d'oxygène. Ce phénomène n'induit aucune douleur. Il provoque un endormissement et à terme la mort par asphyxie.
A noter que la fumée de cigarette contient elle aussi du $\ce{CO}$. Les fumeurs ont donc une moins bonne condition physique que les non-fumeurs. En effet, certaines de leurs molécules d'hémoglobine n'étant plus fonctionnelles, ils s'essouffleront plus rapidement.
Un bec bunsen utilise comme comburant l'oxygène et comme combustible le méthane. Les manettes permettent de gérer la quantité de combustible fournie, la virole la quantité d'oxygène amenée. En variant ces deux facteurs, on permet une combustion plus ou moins rapide du méthane et donc on choisit la température de la flamme. Il est à remarquer qu'une flamme bleue est beaucoup plus chaude qu'une flamme jaune.
La pile
Une application directe de la réaction d’oxydoréduction est le phénomène des piles. Quel est le principe général d'une pile ? C'est la transformation d'énergie chimique en énergie électrique. Nous définirons le courant comme étant un déplacement d'électrons2.
Deux couples sont présentes dans cette pile : $\ce{Cu^{2+}/Cu (SO4^{2-})}$ et $\ce{Zn^{2+}/Zn (SO4^{2-})}$. Le couple $\ce{Cu^{2+}/Cu}$ fera une réduction et le couple $\ce{Zn^{2+}/Zn}$ fera une oxydation.
l'oxydation se fait à l'anode (électrode négative) et la réduction se fait à la cathode (électrode positive).
Au départ, [$\ce{Cu^{2+}}$] = [$\ce{SO4^{2-}}$] et $\ce{Zn^{2+}}$ = $\ce{SO4^{2-}}$.
En fonctionnement, [$\ce{Cu^{2+}}$] < [$\ce{SO4^{2-}}$] et [$\ce{Zn^{2+}}$] > [$\ce{SO4^{2-}}$] 1.
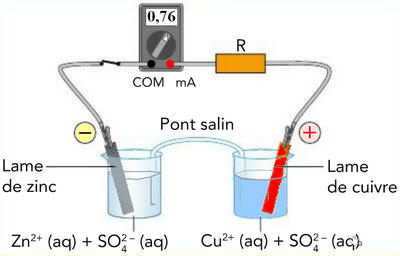
Exemple de pile constituée de deux électrodes, l'une en cuivre, l'autre en zinc. On mesure bien un voltage = tension de la pile.
L'électrode de cuivre augmente de masse au cours du temps tandis que l'électrode de zinc va diminuer de masse au cours du temps. Les deux électrodes et leurs solutions respectives sont appelées demi-piles. Le pont salin va permettre aux ions $\ce{SO4^{2-}}$ de circuler d'un compartiment à l'autre, afin que l'électro neutralité soit maintenue dans chacun des compartiments. Ce pont est constitué soit d'un papier mouillé avec une solution d'un sel ($\ce{NaCl}$, $\ce{KCl}$, ...) soit d'un pont liquide constitué de la solution saline2.
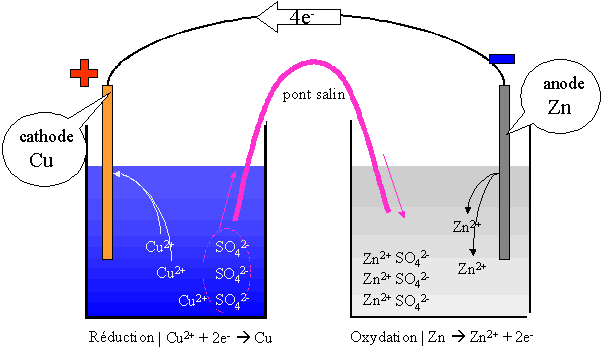
On voit que les électrons se déplacent du zinc au cuivre: ce dernier est en effet "plus fort". Les chimistes disent qu'il possède un potentiel de réduction plus élevé. Si l'on parvient à intercepter les électrons, on pourra allumer une ampoule, par exemple.
Potentiels de réduction
Le potentiel de réduction est la mesure de l’aptitude d'un oxydant à se réduire, c'est à dire à capter un ou plusieurs électrons. Le potentiel se mesure en Volt ($\mathrm{V}$): une liste de ces potentiels se trouve dans les Tables CRM. Les valeurs données ont été déterminées aux conditions standard, c'est à dire pour des concentrations égales à $1\,\mathrm{mol}$ dans $1\,\mathrm{L}$ de solution ou des pressions (dans le cas d'un gaz) égales à $1\,\mathrm{atm}$. On peut donc affirmer que l'oxydant avec le potentiel le plus élevé aura tendance à se réduire plus facilement.
Exemple:
\begin{align}
\ce{&Cu^2+} + 2\,\text{électrons} \ce{-> Cu^0} \qquad E^{\circ}=+0,34\,\mathrm{V} \\
\ce{&Zn^2+} + 2\,\text{électrons} \ce{-> Zn^0} \qquad E^{\circ}=-0,76\,\mathrm{V} \\
\end{align}
Imaginons donc du $\ce{Zn^{0}}$ métallique immergé dans une solution de cuivre $\ce{Cu^2+}$. Ce dernier aura tendance à se réduire, car son potentiel de réduction est plus élevé, au détriment du $\ce{Zn^{0}}$ qui sera oxydé.
L'équation simplifié sera donc:
\begin{align} \ce{&Cu^2+ + Zn^0 -> Cu^0 + Zn^2+} \end{align}
Notez que nous avons au final la réduction du cuivre et l'oxydation du zinc: nous avons en effet dû inverser l'équation partielle du zinc, pour qu'elle devienne une oxydation.
Force électromotrice d'une pile
La force électromotrice ($ f.e.m. $) est le voltage d'une pile et est donc exprimée en Volt ($\mathrm{V}$). Chaque pile commerciale est caractérisée par une valeur précise de la force électromotrice. Elle se calcule de la façon suivante:
$$ f.e.m. =\Delta E^{\circ}= E^{\circ}_{cathode}-E^{\circ}_{anode} $$
Le symbole $ \circ $ indique que les concentrations des espèces en solution correspond aux conditions standard de température, pression ou concentration.
Dans le cas du zinc, dans une solution de $\ce{Cu^{2+}}$, on aura:
$$ f.e.m.=0,34 - (-0,76)=1,1\,\mathrm{V} $$
Exercices SERIE B Réactions d’Oxydoréduction
Soit une pile constituée d'une demi-pile $\ce{Ni^{2+}/Ni}$ associée à une demi-pile $\ce{Co^{2+}/Co}$.
Faites un schéma annoté de la pile.
Ecrivez les réactions se produisant aux électrodes.
Calculez la $ f.e.m. $ de la pile.
Une pile est composée de deux demi-piles : la première est constituée d’une tige d’argent baignant dans une solution d’$\ce{Ag+}$ et la seconde d’une tige de nickel baignant dans une solution de $\ce{Ni^{2+}}$. Après avoir indiqué les deux-demi-réactions, déterminez la $ f.e.m. $ de cette pile.
Pour construire une pile, on dispose de deux béchers, d’un pont salin, d’un voltmètre, de solutions aqueuses de $\ce{FeCl3}$ et de $\ce{CuSO4}$, ainsi que de lames de cuivre et de fer.
Quelle particule va s'oxyder ? Quelle particule va se réduire ?
Écrivez les équations des réactions qui se déroulent aux électrodes
Réalisez un schéma de la pile et indiquez les éléments présents dans une pile:
| Les éléments présents dans une pile |
|---|
| Le sens du mouvement des électrons |
| Le sens du courant |
| L’anode et la cathode |
| Le sens de chaque type d’ions dans les deux solutions |
Bibliographie
Voici quelques liens consultés et/ou repris tels quels. Merci à leurs auteurs pour le précieux partage de ces ressources: