Liaisons et molécules
Comment la matière peut-elle se former à partir d'atomes ? Ces derniers sont des briques, assimilables à des pièces de Lego. Nous verrons que la plupart des atomes, tels qu'on les a étudiés au chapitre précédant, sont instables. En essayant d'aboutir à une situation plus stable et donc favorable, les atomes subissent des modifications: se forment ainsi les ions (= particules chargées); ou des liaisons entre les atomes comme dans une molécule (= ensemble neutre d'atomes). Le résultat de ces transformations aboutit à la formation de toute sorte de matière: tandis que le nombre d'éléments est fini et égal à $118$, le nombre de molécules est infini et ne cesse d'augmenter ! L'objectif de ce chapitre est de comprendre comment les atomes se combinent pour former des molécules et pourquoi ils peuvent parfois perdre ou gagner des électrons.
Les ions
Un ion est un atome ou un groupe d’atomes, qui a gagné ou perdu un ou plusieurs électrons. Pour comprendre comment un ion se forme, considérons ce qui a lieu dans le cas du sodium ($\ce{Na}$) et du chlore ($\ce{Cl}$) : Avec un électron en moins, le sodium, qui n’a plus que $11$ protons et $10$ électrons possède maintenant une charge nette de $1+$. Il est ainsi devenu un ion positif, qu’on nomme cation. Pour représenter l’ion sodium, on utilise le symbole $\ce{Na+}$ et pour représenter sa formation, on recourt à l’équation suivante : $$ \ce{Na -> Na+ + e^-} $$
Si on ajoute un électron à un atome de chlore, ce dernier possède une charge nette de $1-$ ($17$ protons et $18$ électrons). Le chlore est ainsi devenu un ion négatif, qu’on nomme anion. La formation de l’ion chlorure ($\ce{Cl-}$) a lieu selon l’équation suivante :
$$ \ce{Cl + e^- -> Cl-} $$
L'ordre chronologique n'est pas forcement celui delinéé ci-dessus. La question que l'on peut se poser est: Y a-t-il eu d'abord les atomes ou les ions ? Question qui ressemble au paradoxe : Qu'est-ce qui est apparu en premier : l'œuf ou la poule ? Soumis aux conditions extrèmes au sein des étoiles, les noyaux des atomes ont vu le jour dans une mer d'électrons. Puis, quand la température a baissé, les noyaux ont réussi à s'approprier les électrons, ce qui a produit des ensembles neutres, les atomes. Toutefois, Il est fort probable que lorsque les atomes ont commencé à intéragir entre eux, les ions et les molécules se soient très rapidement formés. Car, en nature, on ne s'arrete pas tant que la stabilité n'est pas atteinte.
L'oeuf ou la poule ? D'abord les atomes ou plutôt les ions ?
Règles de l'octet
Transformations subies par les atomes
Lorsque les atomes subissent des transformations (transformation en ion monoatomique ou lorsque qu'ils établissent des liaisons avec d'autres atomes) ils le font de façon à saturer leur couche externe. Les électrons de cœur (sur les couches internes) ne participent pas à la formation des molécules.
$e^-$ externes = $e^-$ périphériques = $e^-$ de valence*
Atomes chimiquement stables
Les atomes dont la couche externe est déjà saturée sont dits "chimiquement stables". On dit aussi qu'ils présentent une grande inertie chimique. En effet, les éléments de la dernière colonne du tableau périodique (que l'on appelle gaz rares ou nobles) se caractérisent par une tendance moins prononcée (par rapport aux autres éléments) de se lier entre eux ou avec d'autres éléments.
Règle de l'octet Au cours de leurs transformations chimiques, les atomes évoluent de manière à saturer leur couche externe ($1$) ou ($2$) etc. Les atomes des éléments de $Z > 4$ acquièrent un "octet" d'électrons c'est-à-dire $8$ électrons ou $4$ paires d'électrons, alors que les atomes des éléments de $Z < 4$ complètent la 1ère couche avec $2$ électrons externes.
Cette règle n’est pas universelle. Elle ne marche pas toujours. Pour la suite du cours, nous pouvons se contenter de dire que la règle de l’octet marche surtout pour les éléments de $Z < 10$ (on trouve des exceptions chez le bore et le béryllium, notamment). Pour les éléments de $Z > 10$, cette règle n’est souvent pas respectée.
Prévision de la charge des ions monoatomiques
L'application de la règle de l’octet permet de prévoir la charge et donc la formule de la plus part des ions monoatomiques.
Considérons l'atome de fluor ($\ce{F}$) de numéro atomique $Z=9$ dont la structure électronique est: $1^2 2^7$. Il possède $7$ électrons sur sa couche externe ($2$). En se transformant en ion fluorure, il complète cette couche externe avec un octet ($8$) d’électrons. Cet atome, initialement neutre du point de vue électrique, va donc gagner un électron c'est-à-dire une charge négative lors de sa transformation en ion fluorure. La formule de cet ion est alors: $\ce{F-}$
Exercices
Formation des molécules
Comment les atomes peuvent-ils saturer (=compléter) leur couche externe ? En d’autres termes, où trouvent-ils les électrons qui leur permettent d’atteindre l’octet externe ? Par le partage des électrons, qui a très souvent lieu lors de la formation d’une molécule, les atomes parviennent à saturer leur couche externe. Il est rare que les atomes soient isolés dans la nature car ils ont tendance à s’associer en ensembles neutres d’atomes : les molécules.
Liaison covalente
Une liaison covalente entre deux atomes correspond à la mise en commun entre ces deux atomes de deux électrons de leurs couches externes pour former un doublet d'électrons appelé doublet liant ou paire liante.
Le doublet liant, mis en commun entre les deux atomes, est considéré comme appartenant à chacun des atomes liés.
Prévision du nombre de liaisons covalentes que peut établir un atome
Le nombre de liaisons covalentes que peut établir un atome, satisfaisant la règle de l’octet, dépend du nombre d'électrons que présente cet atome sur sa couche externe. Rappelons que: Pour l'hydrogène dont seule la couche $1$ est concernée, on peut prévoir que cet atome peut former une liaison covalente. Pour les atomes des autres éléments dont les couches externes sont $2$ ou $3$ et qui possèdent un nombre $x$ d’électrons dans cette couche externe (ils appartiennent alors à la colonne $x$), la règle de l'octet permet de prévoir qu'ils peuvent établir $8-x$ liaisons covalentes.
Nombre de liaisons = $8 - x$
L'oxygène se situe dans la colonne $x=6$. Un atome d'oxygène pourra établir un nombre de liaisons covalentes tel que:
nb(liaisons) $= 8 - x$
$=>$ nb(liaisons) $= 8 - 6$
$=>$ nb(liaisons) $= 2$
Représentation de Lewis des molécules
La représentation de Lewis d’un atome est constituée du symbole chimique de l’élément muni d’un point par électron de valence.

Les formules de Lewis pour quelques éléments.
Un point isolé représente un électron célibataire dans une orbitale. Un couple de points représente une paire d’électrons dans la même orbitale.
Paires liantes
Les paires liantes ont été définies précédemment comme les paires d'électrons mises en commun entre deux atomes. Ce sont elles qui assurent les liaisons entre les atomes.
Paires non liantes
Les paires non liantes sont les paires d'électrons qui ne servent pas de liaison entre deux atomes.
La représentation de Lewis d'une molécule fait apparaître tous les atomes de la molécule ainsi que toutes les paires liantes et non liantes, le cas échéant.
L’hydrogène forme des molécules stables chaque fois qu’il partage deux électrons. La représentation de Lewis pour la molécule de $\ce{H2}$ est la suivante :

La formule de Lewis de $\ce{H2}$.
Exercices
On veut représenter le modèle de Lewis de la molécule de chlorure d'hydrogène
$\ce{HCl}$ ($\ce{H}$: $Z=1$; $\ce{Cl}$: $Z=17$). La formule de Lewis de la molécule est donnée ci dessous à gauche. Pour représenter chaque doublet liant, on utilise une ligne au lieu d’une paire de points (schéma à droite) :

La formule de Lewis de $\ce{HCl}$.
Exercices
Nous pouvons parfois hésiter sur la disposition des atomes dans un diagramme de Lewis. Une règle consiste à disposer les atomes de façon symétrique autour de l’atome central.
Molécule de $\ce{SO2}$, on écrit $\ce{O S O}$, et non $\ce{S O O}$ !!
Exercices
Les formules d'une molécule
Suivant les besoins, les chimistes disposent de plusieurs formules pour une molécule donnée.
(a) formule brute: elle indique la nature et le nombre des atomes présents dans le composé.
(b) formule de Lewis: elle fait apparaître tous les atomes et toutes les liaisons entre les atomes du composé.
Symboles chimiques
$\ce{H}$ : écriture symbolique représentant $1$ atome d'hydrogène ou l'élément hydrogène.
$\ce{4 H}$ : $4$ atomes d'hydrogène ; les atomes sont indépendants c'est-à-dire non liés entre eux.
$\ce{H2}$ : ensemble formé de $2$ atomes d'hydrogène liés entre eux qu'on appelle molécule.
$\ce{H2O}$ : écriture symbolique d'$1$ molécule d'eau. Cette molécule se compose de $2$ atomes d'hydrogène et d'un atome d'oxygène, ces trois atomes étant liés.
$\ce{3 H2O}$ : $3$ molécules d'eau ($9$ atomes en tout) ; ces $3$ molécules sont indépendantes c'est-à-dire qu'elles ne sont pas liées entre elles.
$\ce{2 Fe(OH)3}$ : 2 molécules d'hydroxyde de fer (chaque molécule est formée de $7$ atomes liés ; il y donc $14$ atomes en tout).
| $\ce{H2}$ | $\ne$ | $\ce{2 H}$ |
|---|---|---|
| $2$ atomes liés et formant une molécule | $2$ atomes indépendants et non liés entre eux |
| $\ce{Co}$ | $\ne$ | $\ce{CO}$ |
|---|---|---|
| $1$ atome de cobalt | $1$ molécule formée d’un atome de carbone lié à un atome d’oxygène |
Exercice
Géométrie des molécules simples
Par molécule simple, on entend une molécule pour laquelle le choix d'un atome central est aisé.
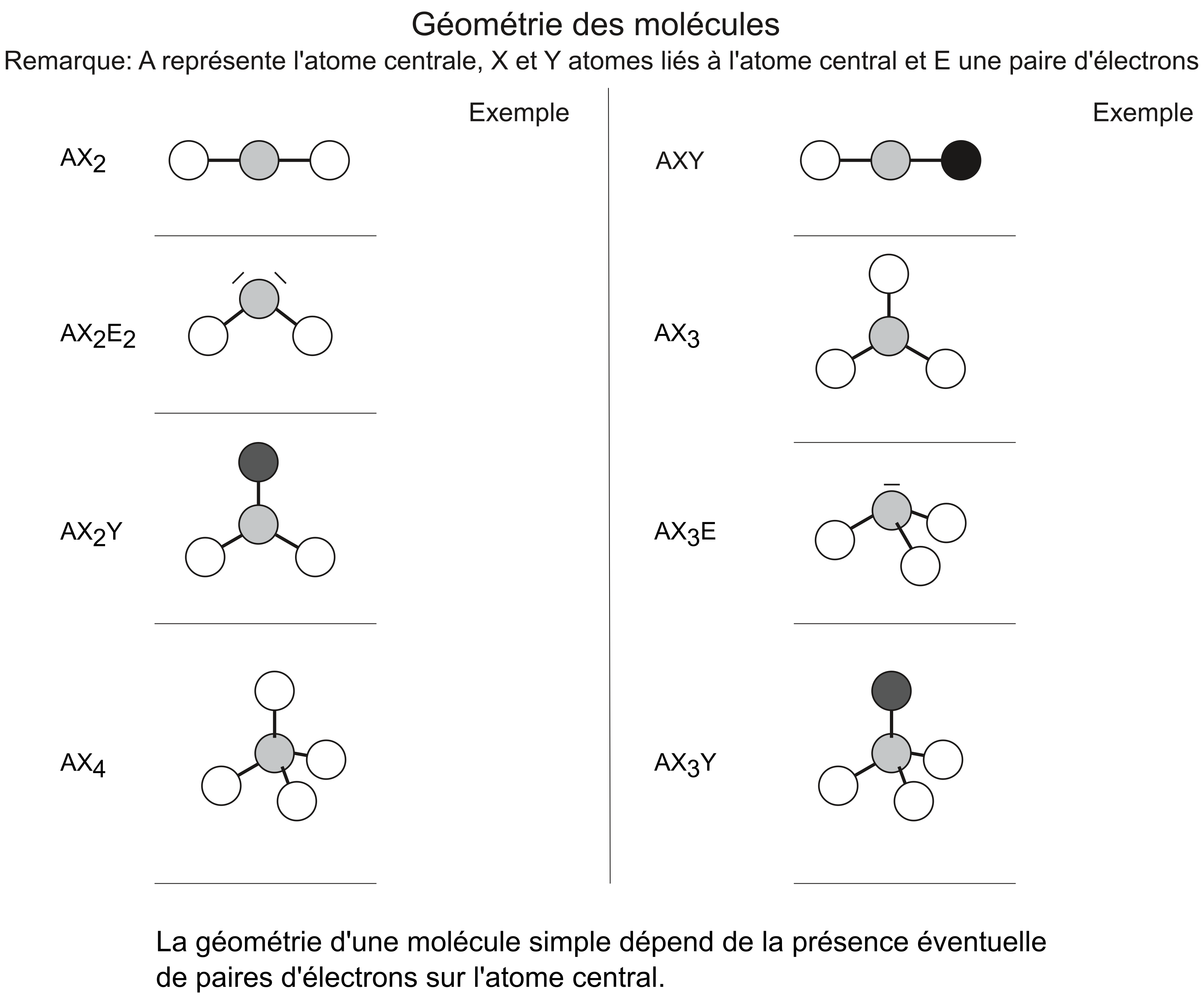
On peut prédire la géométrie d'une molécule: celle-ci est importante pour comprendre les termes hydrophile et hydrophobe.
Nous verrons en cours d'autres exemples permettant de comprendre comment il est possible de prédire la géométrie d'une molécule.
Exercices SERIE Liaisons et Molecules A
($Z=16$). Quels sont les atomes qui ont tendance à donner?

Le modèle de l'oxyde de diméthyle (= diméthyléther)
Le modèle de l'éthanal (= acétaldéhyde)
Molécules à plus de deux éléments (polyatomiques)
Cas des sels et des oxacides (=acides avec oxygène)
Afin d'obtenir un développement correct des molécules polyatomiques, on peut placer les éléments dans différentes colonnes :
| A Métal et/ou hydrogène |
B Autant d’oxygènes que d’$e^-$ célibataires dans la colonne A |
C Non-métal |
D Oxygène(s) restant(s) |
|
|---|---|---|---|---|
| $\ce{Na2CO3}$ | ||||
| $\ce{Ca(NO2)2}$ |
Cas des hydroxydes
Ce sont des molécules qui contiennent le groupe d'atomes $\ce{-OH}$. Ce groupe est toujours attaché à un métal ou un métal de transition.
| A Métal |
B Atome(s) d’oxygène |
C Atome(s) d’hydrogènes |
|
|---|---|---|---|
| $\ce{NaOH}$ | |||
| $\ce{Mg(OH)2}$ |
Electronégativité
L’électronégativité (ou indice d’électronégativité) permet de comparer la tendance à perdre ou à gagner des électrons par les différents éléments. C’est une propriété d’un élément, elle est donc indiquée sur le tableau périodique.
Caractère ionique ou covalent d’une liaison
La différence d’électronégativité $\Delta E_n$ entre deux éléments permet d’identifier la nature d’une liaison :
| $\Delta E_n = 0$ | $0 < \Delta E_n < 1,7$ | $\Delta E_n > 1,7$ |
|---|---|---|
| la liaison est COVALENTE NON-POLAIRE (dite également PURE) | la liaison est COVALENTE POLAIRE | la liaison est IONIQUE |

Les liaisons chimiques ne sont pas toutes équivalentes : ceci, car les éléments chimiques n'ont pas tous la même électronégativité.
Exercice
Exemple de liaison covalente polaire, le cas du $\ce{H2O}$.
Formons une molécule d'eau constituée d'un atome d'oxygène et de deux atomes d'hydrogène. Les liaisons sont formées par la mise en commun des célibataires: la formule brute de l’eau est $\ce{H2O}$.
On note que les électrons mis en commun dans la liaison sont plus près de l'oxygène car son électronégativité est plus grande que celle de l'hydrogène.
L'oxygène plus électronégatif que l'hydrogène a tendance à attirer les électrons du doublet liant. Il apparaît deux fractions de charge négative ($2\delta^{-}$) sur l'oxygène et une fraction de charge positive $\delta^{+}$ sur chaque hydrogène.

La formule de Lewis pour la molécule d'eau, $\ce{H2O}$

Le caractère ionique augmente avec la différence d'électronégativité $\Delta E_n$: on peut affirmer que lorsque $\Delta E_n=1,7$, le caractère ionique d'une liaison est égal à $50%$.
Liaison ionique
C'est la liaison qui résulte du passage d'un électron célibataire de l'atome d’indice d’électronégativité le plus faible vers celui d’indice d’électronégativité le plus élevé. On forme, en fait, deux ions de charges opposées attirés par la force électrostatique pour constituer une molécule électriquement neutre.
Exemple de liaison iondique, le cas du $\ce{NaCl}$.
L'atome de sodium perd son seul célibataire et le donne au chlore:
L'atome de chlore qui possède 7 électrons externes capte le célibataire du sodium :
Il se forme ainsi un CATION $\ce{Na+}$ dont la structure électronique externe est semblable à celle du .................. et un ANION $\ce{Cl-}$ (ion négatif) dont la structure externe est semblable à celle de .............................
On résume la formation de cette molécule par :

La liaison ionique dans le réseau cristallin du $\ce{NaCl}$.
L'anion chlorure $\ce{Cl-}$ a le même nombre d'électrons que l'argon : $18$ électrons. Ces ions, les uns positifs et les autres négatifs, sont attirés les uns vers les autres par une force électrostatique et s’empilent d’une manière régulière, aussi compacte que possible, les $\ce{Na+}$ alternant avec les $\ce{Cl-}$, pour former le cristal de chlorure de sodium (sel ordinaire), qui n’est pas un composé covalent, mais un composé «ionique»1. Lorsqu'il se dissout dans l'eau, les ions $\ce{Na+}$ et $\ce{Cl-}$ se séparent. L'eau salée ne contient pas de molécules de $\ce{NaCl}$, mais des cations $\ce{Na+}$ et des anions $\ce{Cl-}$, très stables.
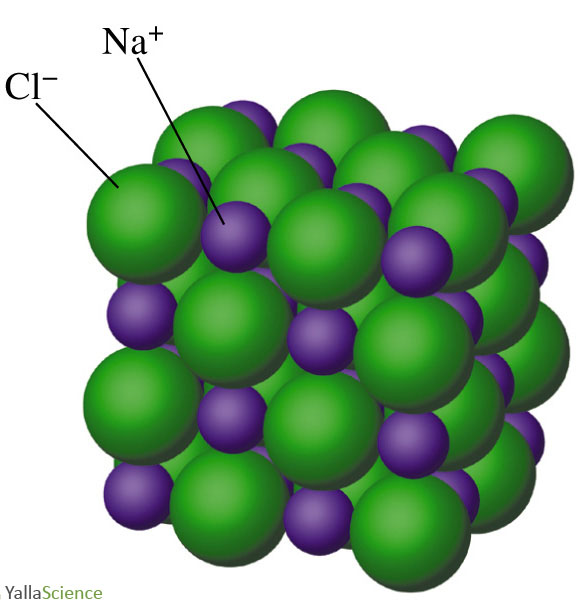
La formule $\ce{NaCl}$ donne l'unité répétitive constitituée d'un ion $\ce{Na+}$ et d'un ion $\ce{Cl-}$. Dans un échantillon de sel de cuisine, plusieurs unités répétitives de $\ce{NaCl}$ sont présentes dans un réseau ordonné.
Exercice
Nombre d’oxydation
Le nombre d'oxydation correspond au nombre de charges qu’aurait un atome dans une molécule si les électrons étaient complètement transfères.
- L’atome qui a l'électronégativité la plus grande gagne un ou plusieurs électrons
- Celui qui a l'électronégativité la plus petite perd un ou plusieurs électrons
- Si les 2 atomes ont la même électronégativité, les 2 atomes restent neutres et leurs n.o. = 0
- Une molécule est globalement neutre : la somme algébrique des n.o. de ses atomes est TOUJOURS égale à ZERO
- Vous trouvez le nombre d’oxydation de chaque élément sur le tableau périodique !
On remarque que certains éléments ont plusieurs nombres d’oxydation.
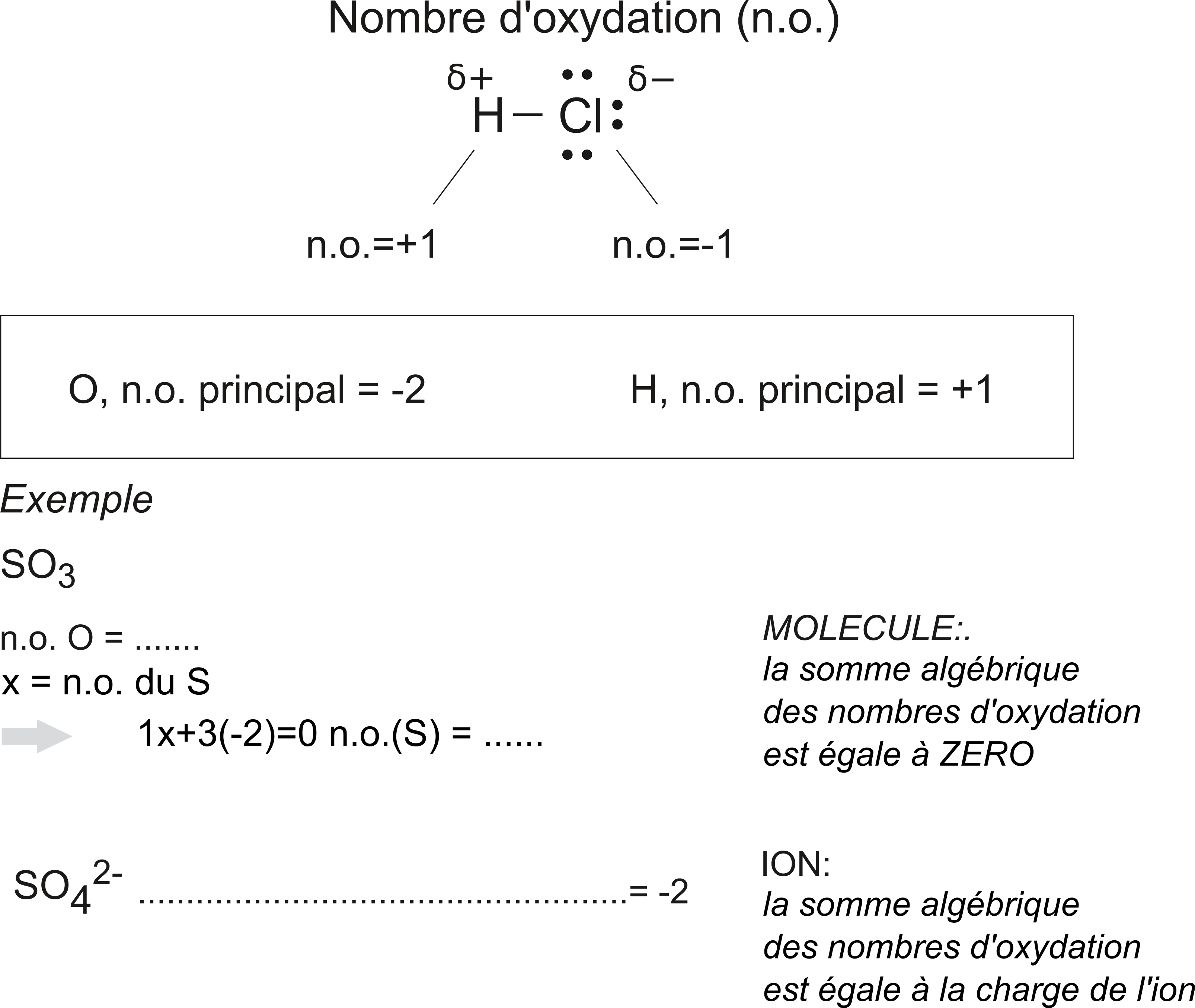
Comment déterminer le nombre d'oxydation pour chaque élément dans une molécule ou un ion ?
Exercice
Les réseaux covalents
L'atome de carbone a tendance à s’assembler avec un nombre innombrable d'autres atomes de carbone2. Chaque carbone se lie directement avec quatre autres carbones. Pourquoi ?
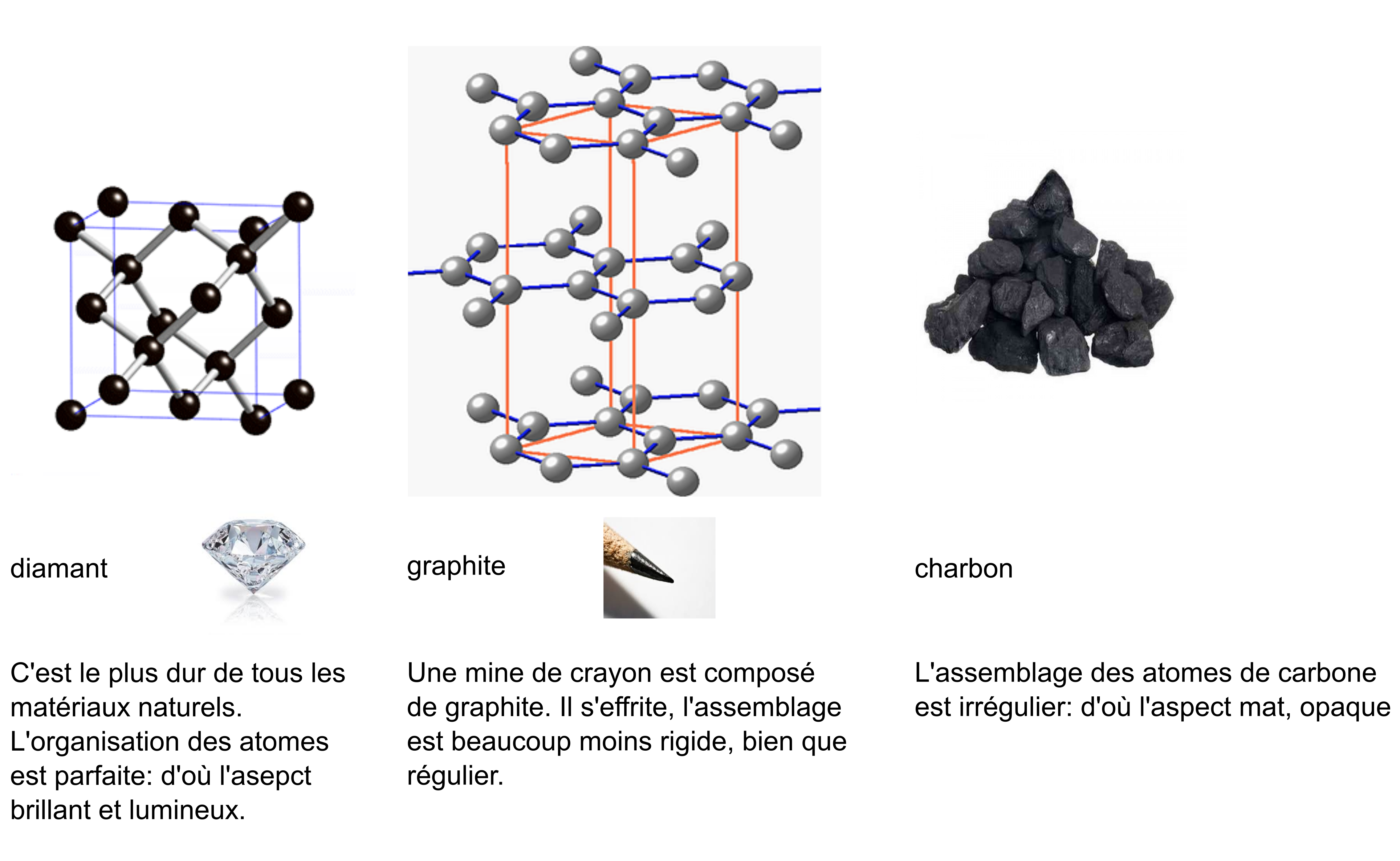
Différents assemblages du carbone: diamant, graphite et charbon.
Quelle est la principale différence entre le diamant et le graphite au niveau de l’assemblage des carbones?
Ces assemblages sont-ils des molécules ?
Comment pourrait-on donner une formule brute de ces réseaux d’atomes de carbone ?
Les métaux
Dans un métal (ou un élément de transition), tous les atomes sont identiques et le métal est électriquement neutre. Leur cohésion est forte, car on peut considérer qu'un fragment de métal est un empilement de cations baignés dans un nuage d'électrons externes. Les électrons externes peuvent passer d'un atome à l'autre, assurant la cohésion du métal et sa propriété de conducteur d’électricité3.
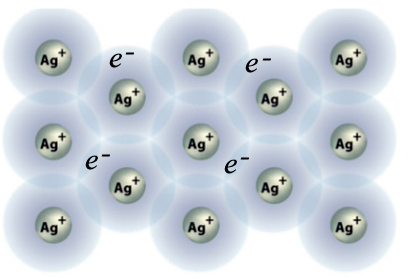
La liaison métallique: les électrons externes peuvent facilement se déplacer à l'intérieur d'un réseau régulier d'atomes. Voici le modèle simplifié pour l'argent.
Composition de la matière
La matière se trouve généralement sous forme de mélanges. On distingue les mélanges hétérogènes immédiatement discernables à l'œil nu ou au microscope. Ex : …………………………
Des mélanges homogènes indiscernables même au microscope. Ex. ……………….
Il est possible de séparer les constituants d'un mélange pour obtenir des corps purs. Les techniques employées sont physiques et n'ont aucune action sur la nature des produits séparés. Le mélange peut être reconstitué.

Corps purs et mélanges.
Quelques techniques de séparation
La filtration (mélange liquide - solide)
Lorsque le solide se dépose difficilement, on fait passer le mélange au travers d'un papier filtre ou d'un verre fritté. Cette opération peut se faire à pression atmosphérique ou encore sous vide. Cette technique est basée sur la grosseur des particules.
La décantation (mélange liquide - liquide ou liquide - solide)
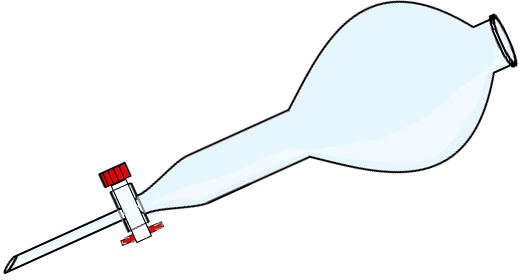
Ampoule à décanter. Si le mélange se présente sous la forme d'un solide mélangé à un liquide, ou de deux liquides non miscibles, la décantation est l'opération la plus simple pour séparer les constituants du mélange. Cette technique n'est possible que si le solide se dépose facilement au fond du récipient. Elle est basée sur la force de gravité qui agit sur la masse volumique des substances mélangées.
La centrifugation (mélange liquide - solide)
Lorsque la décantation ou la filtration sont difficiles à réaliser, la technique la plus simple pour séparer un mélange solide - liquide est la centrifugation, sorte de décantation accélérée. Cette opération met à profit la force centrifuge (100 à 1000 fois la force de gravité). On provoque ainsi la sédimentation du solide au fond de l'éprouvette.
La distillation (mélange liquide - liquide)
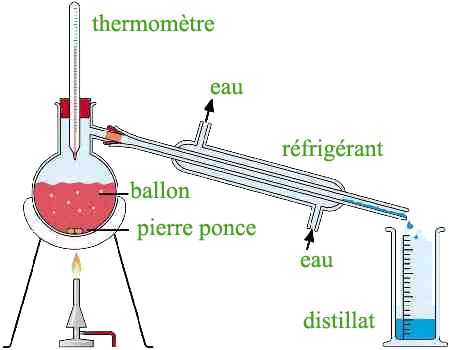
Distillateur. Sous l’action de la chaleur, les constituants d’un mélange de liquides vont se vaporiser au fur et à mesure que leur température d’ébullition est atteinte. On récupère alors les produits purs en condensant les fractions par refroidissement. Cette technique est basée sur la différence de point d'ébullition.
L'aimantation (mélange solide - solide ou liquide - solide)
Cette technique est basée sur les propriétés magnétiques des substances à séparer. Ex : tri du verre usagé.
L'évaporation (mélange liquide - solide)
Technique basée sur l'évaporation du solvant. Ex : marais salant, dessalement de l'eau de mer.
Exercices SERIE Liasons et Molecules B
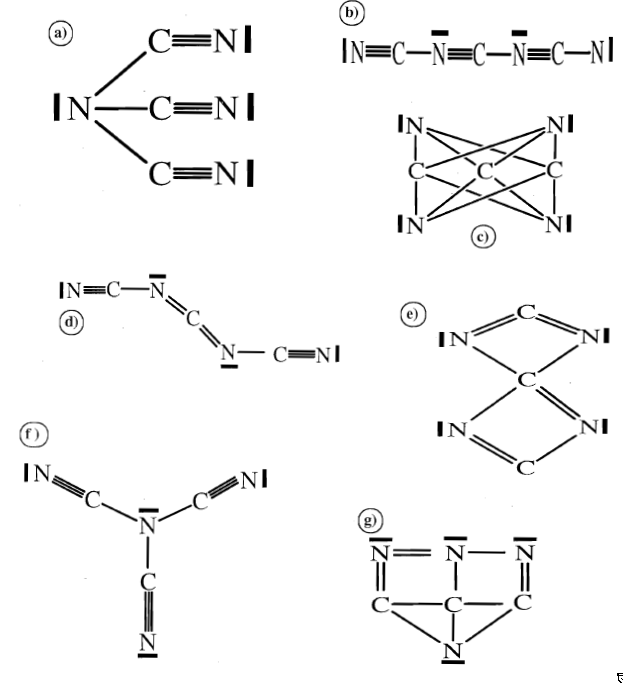
L'octet ($8e^-$) est-il satisfait partout ?
| $\ce{Al^{3+}}$ | $\ce{Ca^{2+}}$ | $\ce{SO4^{2-}}$ | $\ce{F-}$ |
| $\ce{PO4^{3-}}$ | $\ce{H+}$ | $\ce{OH-}$ | $\ce{Sn^{4+}}$ |
| Manganèse $\ce{Mn}$ |
$\ce{OH-}$ | $\ce{Cl-}$ | $\ce{PO4^{3-}}$ | $\ce{CO3^{2-}}$ | $\ce{SO4^{2-}}$ |
| $\ce{Mn(II)}$ | |||||
| $\ce{Mn(III)}$ | |||||
| $\ce{Mn(IV)}$ | |||||
| $\ce{Mn(V)}$ | |||||
| $\ce{Mn(VI)}$ | |||||
| $\ce{Mn(VII)}$ |
| □ le fer | □ l'eau distillée | □ l'acier |
| □ l'air (en montagne) | □ le whisky |
| □ la mousse au chocolat | □ la fumée de pipe | □ l’eau minérale plate |
| □ la viande | □ le sirop de framboises |
| □ le lait | □ le bois | □ l'eau gazeuse |
| □ de l’eau contenant du sel de cuisine | □ aliage or-argent |
- mélange homogène formé de 2 constituants liquides
- mélange homogène formé de 2 constituants gazeux
- mélange homogène formé d’un solide et d’un liquide
- mélange hétérogène formé de 2 constituants solides
- mélange hétérogène formé de 2 constituants liquides
- mélange hétérogène formé d’un solide et d’un liquide
La polarité des molécules
La molécule d'eau: un exemple de molécule polaire
Si on fait couler un filet d'eau pour étudier l'effet d'une baguette chargée en électricité statique, on notera que le filet d'eau est dévié.
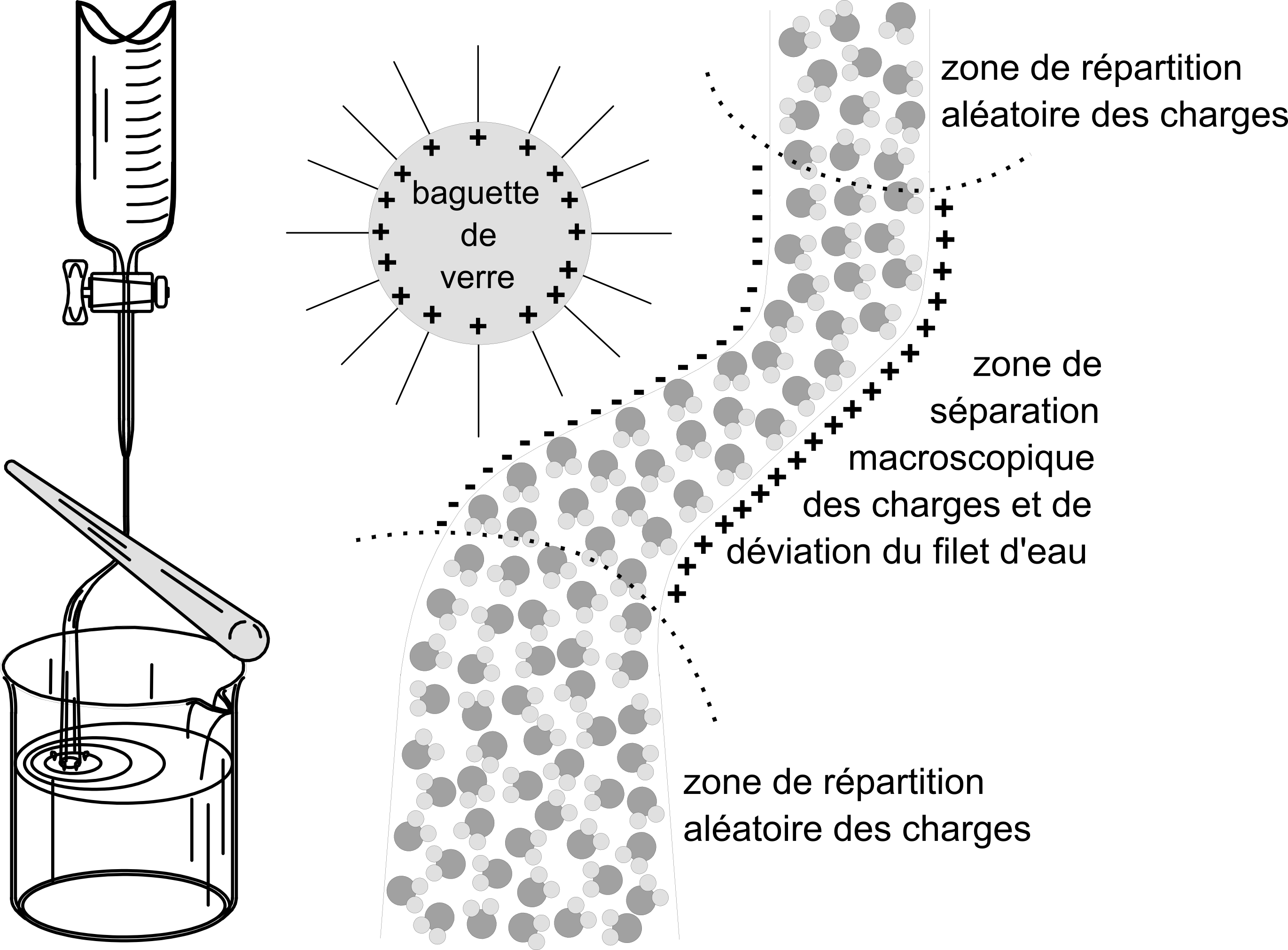
L'eau est déviée par la baguette chargée. Observez l'arrangement des molécules d'eau dans la portion du filet où l'effet de la baguette se manifeste.
On en déduit que la molécule d'$\ce{H2O}$ est une molécule polaire.
On change de liquide et on étudie l'effet de la baguette chargée sur l'hexane. Aucune déviation cette fois-ci.
On en déduit que la molécule de l'hexane (de formule brute $\ce{C6H14}$) est une molécule apolaire.

La formule de Lewis de l'hexane ($\ce{C6H14}$).
Comment expliquer cette différence ?
Géométrie des molécules et leur polarité

Les charges partielles créent un dipôle électrique (= $\delta -$ et $\delta +$), symbolisé dans l'image par une flèche
Remarquez la différence entre liaison polaire et ** molécule polaire**. Dans $\ce{CO2}$ les deux dipôles, identiques, sont orientés dans des directions opposées et vont donc s'annuler. En revanche pour l'eau, ils ne s'annulent pas car la géométrie n'est pas linéaire.

Dans la molécule d'eau les deux dipôles ne sont pas alignés. Ils ne s'annulent pas.

Voici pourquoi la molécule de l'hexane est apolaire. Chaque dipôle est annulé par un autre identique ayant une direction opposée

Que se passe-t-il dans le cas d'une molécule trigonale et symétrique ? Voici le cas de $\ce{BF3}$.
Substances hydrophiles et hydrophobes
L'eau et l'hexane ne se mélangent pas, car:
- $\ce{H2O}$ est une molécule polaire
- la molécule de l'hexane, $\ce{C6H14}$, est apolaire

Le papier noirci d'un seul coté se place à l'interface eau/hexane d'une manière bien définie: la face noire en haut au contact avec l'hexane, la face blanche en bas au contact avec l'eau.
| Proposer ici à droite une hypothèse permettant d'expliquer l'affinité sélective des carrès pour l'hexane, pour l'eau et, dans certains cas, pour les parois de l'ampoule à décanter. |
Bibliographie
Voici quelques liens consultés et/ou repris tels quels. Merci à leurs auteurs pour le précieux partage de ces ressources: