Electrochimie
L'électrochimie est une branche de la chimie qui explore les interactions entre les phénomènes chimiques et électriques. Elle joue un rôle crucial dans de nombreux domaines de notre vie quotidienne et de la recherche scientifique. De la production d'énergie propre via les piles à combustible et les batteries, à l'électrolyse utilisée dans l'industrie pour obtenir des métaux purs, en passant par le développement de capteurs électrochimiques pour des applications médicales et environnementales, l'électrochimie est omniprésente. Nous travaillerons au cours de ce chapitre les réactions chimiques spontanées permettant de faire fonctionner un dispositif électrique.
Classification électrochimique des éléments
La réaction suivante a lieu dans un haut fourneau à partir du minerai de fer :
$\ce{Fe2O3 + 3 CO -> 2 Fe + 3 CO2}$
Au cours de cette réaction : - $\ce{Fe^3+}$ se réduit en $\ce{Fe^0}$ - $\ce{C^2+}$ s'oxyde en $\ce{C^4+}$.
Si l'on considère les électronégativités, elles sont de : $1,8$ pour le fer qui devrait donc s'oxyder et $2,5$ pour le carbone qui devrait donc se réduire. Or, c'est l'inverse qui se produit ! Il est donc nécessaire d'établir une autre échelle qui tienne compte de l'état d'oxydation avant et après la réaction. Cette échelle contiendra des valeurs numériques mesurées en volts liées au couples oxred. Les couples oxred de notre réaction sont: $\ce{Fe^3+/Fe^0}$ et $\ce{C^4+/C^2+}$
Construction de l'échelle
Argent - Cuivre
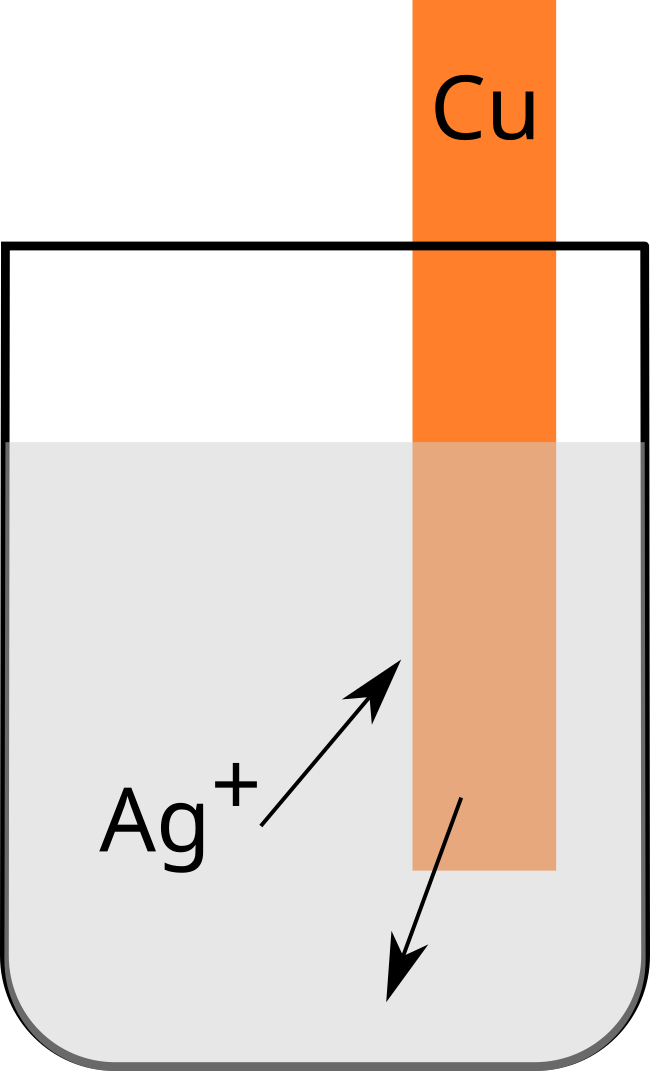
$\ce{Ag+ + 1e^- -> Ag\quad}$ Dépôt d'argent
$\ce{Cu - 2e^- -> Cu^2+\quad}$ Mise en solution du cuivre
Electronégativité de Cu et d'Ag = $1,9$
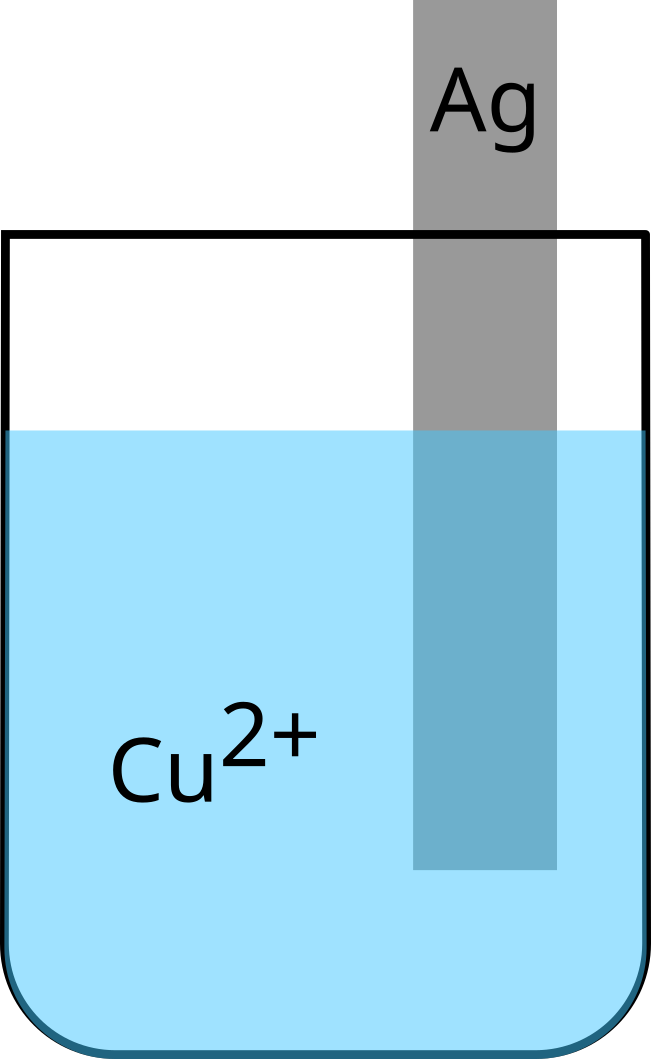
Rien ne se passe
Nous pouvons en conclure que l'argent $\ce{Ag+}$ est plus oxydant que le cuivre $\ce{Cu^2+}$.
Cuivre - Zinc
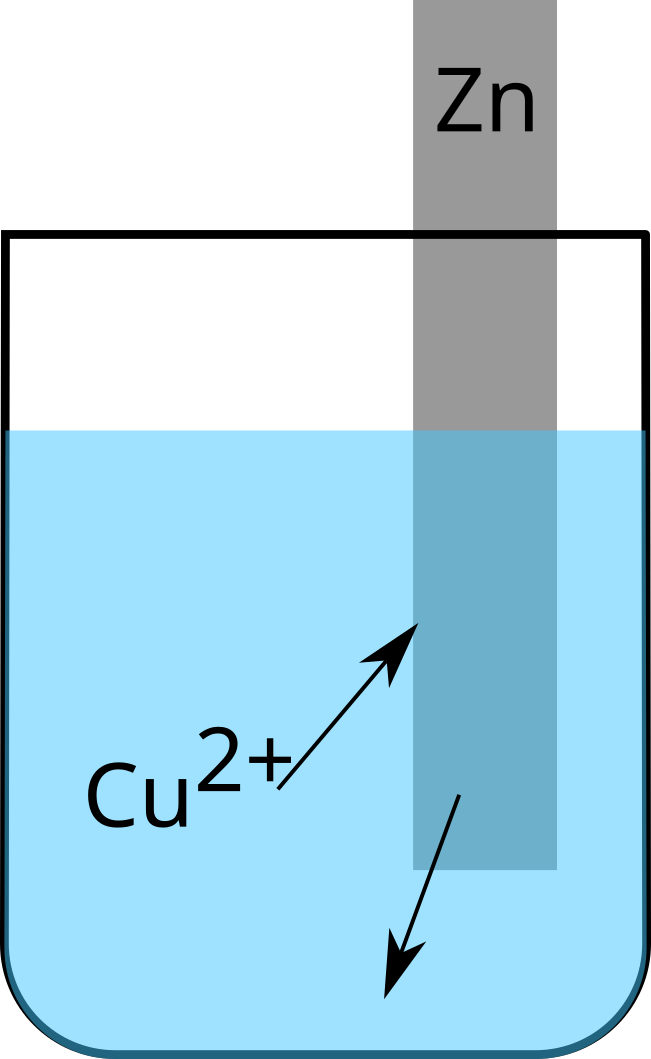
$\ce{Cu^2+ + 2e^- -> Cu\quad}$ Dépôt de cuivre
$\ce{Zn - 2e^- -> Zn^2+\quad}$ Mise en solution du zinc
Electronégativité de Cu = $1,9$; Electronégativité de Zn = $1,6$
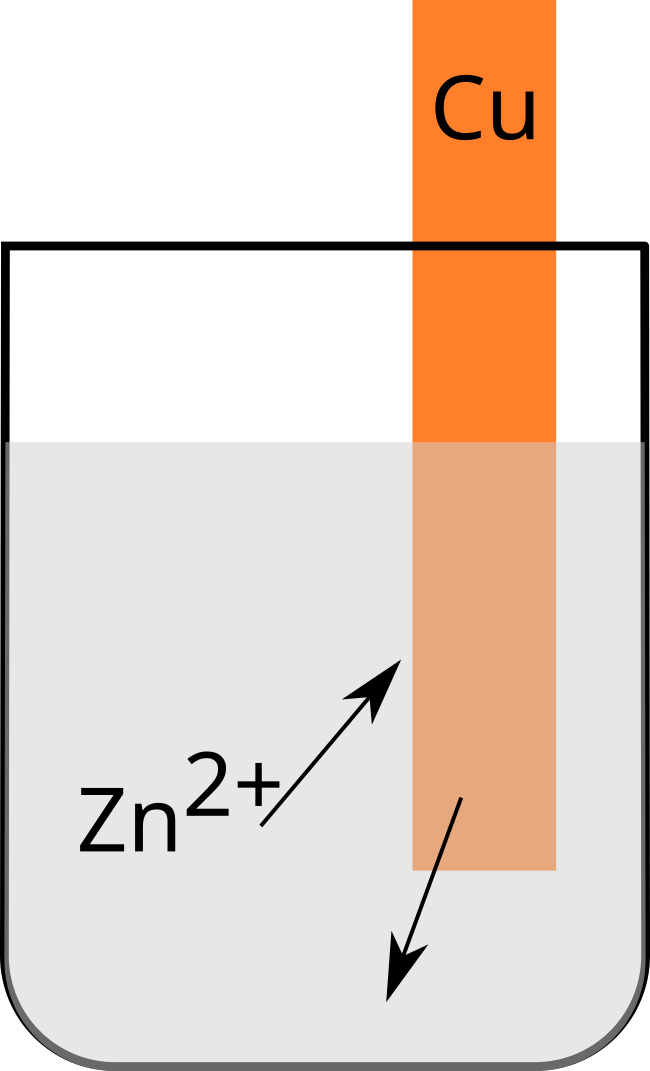
Rien ne se passe
Nous pouvons en conclure que le cuivre $\ce{Cu^2+}$ est plus oxydant que le zinc $\ce{Zn^2+}$.
En conséquence, il est possible de construire une échelle sur laquelle nous placerons les différents couples oxred en situant en haut celui qui a le pouvoir oxydant le plus élevé et en bas celui qui a le pouvoir réducteur le plus élevé. Cette échelle est appelée échelle des potentiels de réduction standard ($E^{\circ}_{red}$).
En utilisant cette échelle des potentiels de réduction, nous pourrons prévoir si des réactions chimiques sont possibles ou non, en se souvenant que lorsque 2 couples sont en présence :
Celui qui a le potentiel le plus élevé se réduit.
Celui qui a le potentiel le plus bas s'oxyde.
Remarques:
- Toute oxydation ou réduction n'est pas possible.
- $\ce{Cu^2+}$ ne peut pas s'oxyder car $\ce{Cu^3+}$ n'existe pas.
- $\ce{Cu^0}$ ne peut pas se réduire car $\ce{Cu^{-}}$ n'existe pas.
- Par convention, le couple $\ce{2 H+/H2}$ a un potentiel de réduction de $0,00\,[V]$.
Utilisation de l'échelle
Peut-on conserver du $\ce{HCl}$ :
a) dans un récipient en cuivre ?
b) dans un récipient en zinc ?
On est en présence de trois couples :
| $\ce{Cu^2+/Cu}$ | $E^{\circ}_{red} = + 0,34\, [V]$ |
| $\ce{2 H+/H2}$ | $E^{\circ}_{red} = 0,00\,[V]$ |
| $\ce{Cl2/2 Cl^{-}}$ | $E^{\circ}_{red} = + 1,36\,[V]$ |
Selon la règle vue ci-dessus, le couple qui a le potentiel de réduction le plus élevé se réduit. Dans ce cas, le chlore ne peut pas se réduire : il est déjà sous sa forme réduite. Le cuivre, qui constitue le récipient, est lui aussi sous sa forme réduite. Il ne peut donc pas être réduit par l'hydrogène $\ce{H+}$, qui ne pourrait d'ailleurs pas s'oxyder.
Du $\ce{HCl}$ peut donc être conservé dans un récipient en cuivre, puisque aucune réaction ne peut se produire.
b) On est, là aussi, en présence de trois couples :
| $\ce{Zn^2+/Zn}$ | $E^{\circ}_{red} = - 0,76\, [V]$ |
| $\ce{2 H+/H2}$ | $E^{\circ}_{red} = 0,00\,[V]$ |
| $\ce{Cl2/2 Cl-}$ | $E^{\circ}_{red} = + 1,36\,[V]$ |
Comme dans le cas précédent, le chlore ne peut pas se réduire. Mais le zinc, qui constitue le récipient, a un potentiel de réduction inférieur à celui de l'hydrogène. Étant sous sa forme réduite ($\ce{Zn}$), il pourra donc être oxydé par l'hydrogène.
Du $\ce{HCl}$ ne peut donc pas être conservé dans un récipient en zinc, qui se perforerait.
Mesure du potentiel de réduction
Pour mesurer le pouvoir réducteur d'un couple oxred, il est nécessaire de construire une pile. Une pile est un appareil dans lequel ont lieu une réaction d'oxydation et une réaction de réduction, mais dans lequel les électrons, au lieu de passer directement du réducteur à l'oxydant, sont détournés pour traverser, par exemple, une ampoule. Une pile est constituée de deux demi-piles.
Demi-piles
Une demi-pile peut être constituée :
-
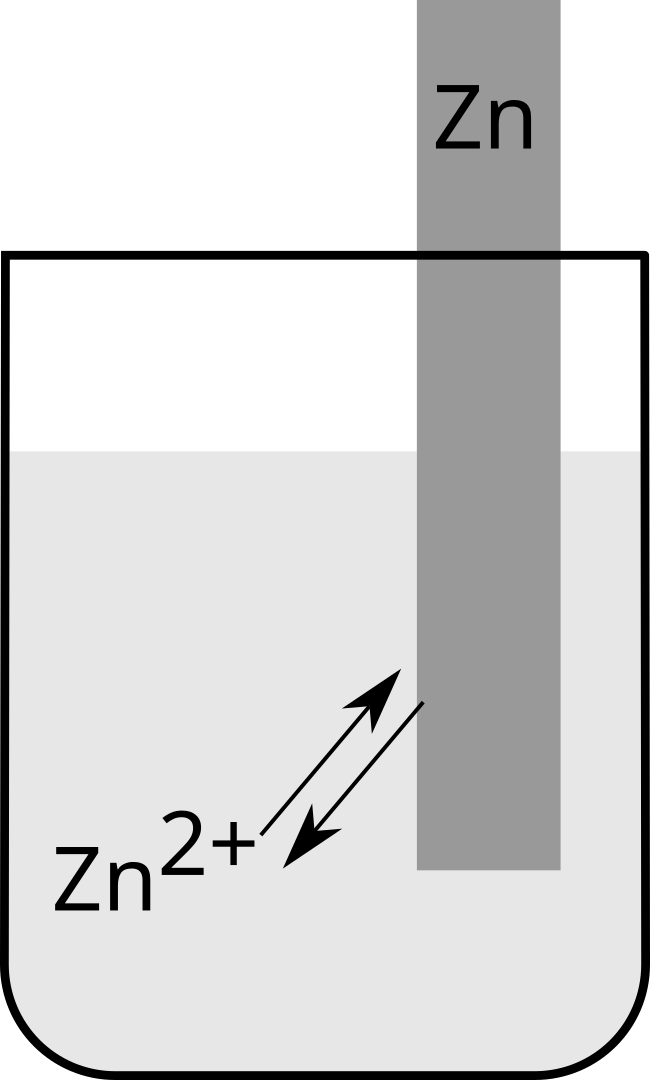
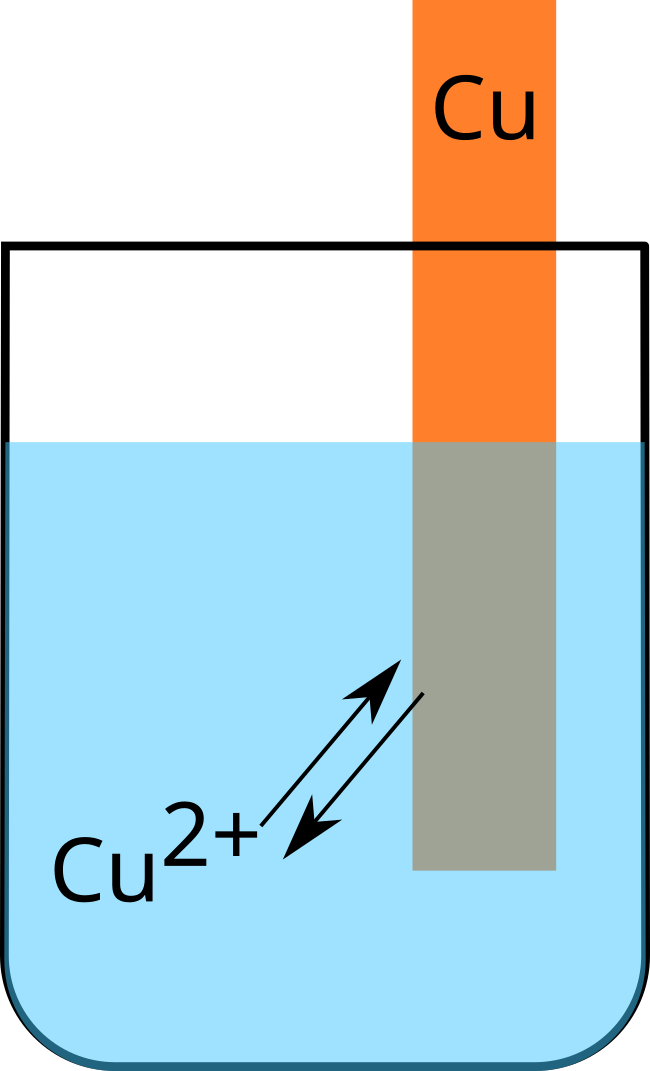
D'un métal plongeant dans une solution contenant ses propres ions (fig. $5$ et $6$).
-
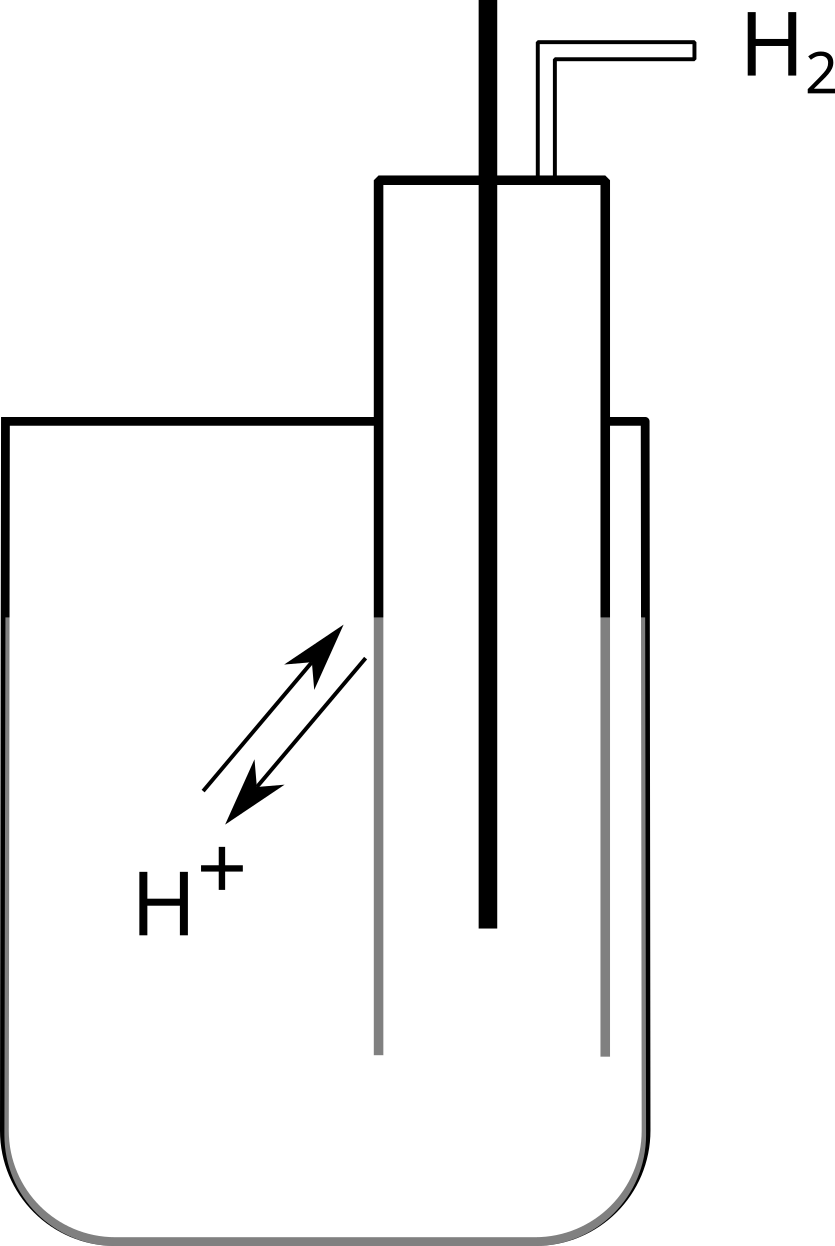
D'un gaz en contact avec une solution contenant ses propres ions (fig. $7$).
-
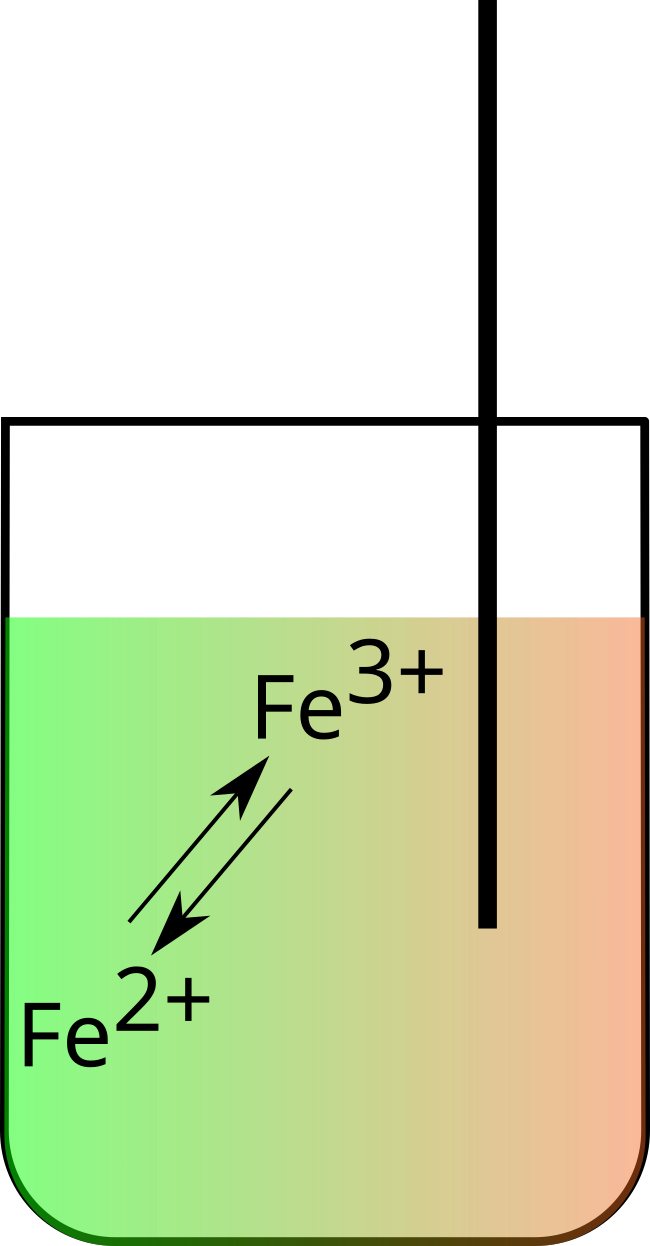
D'une solution contenant des ions d'un même élément sous deux états d'oxydation différents (fig. $8$).
Dans une demi-pile, les particules, sous deux états d'oxydation, sont en équilibre.
 |
 |
|---|---|
$\ce{Zn^2+ +2e^- ⇌ Zn}$ |
$\ce{Cu^2+ +2e^- ⇌ Cu}$ |
 |
 |
$\ce{2H^+ +2e^- ⇌ H2}$ |
$\ce{Fe^3+ +e^- ⇌ Fe^2+}$ |
Piles
Lorsque deux demi-piles sont associées, on obtient une pile. Dans une pile, deux couples sont mis en présence; il y aura donc oxydation dans une demi-pile et réduction dans l'autre en fonction des E° de chacun des couples.
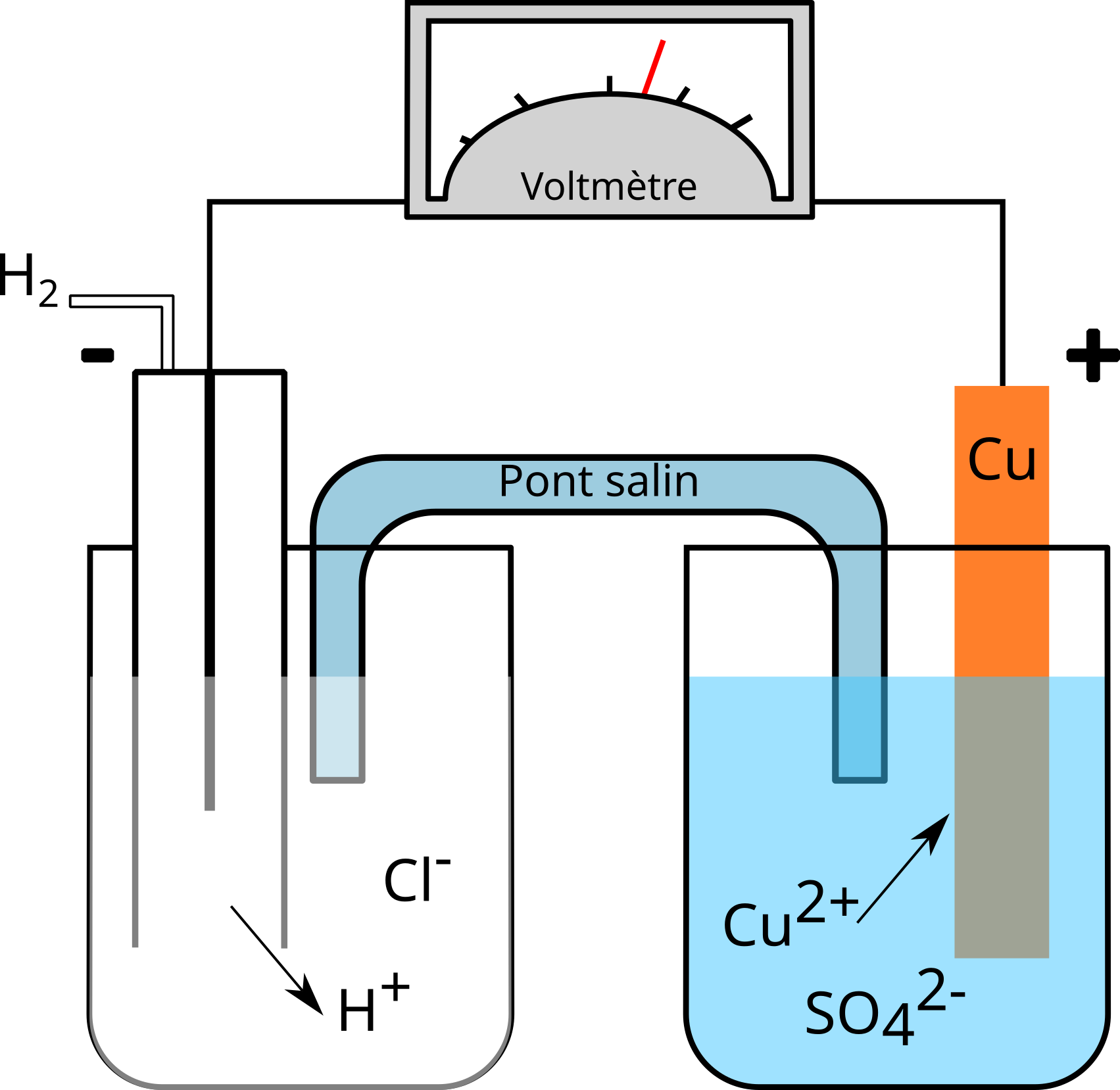
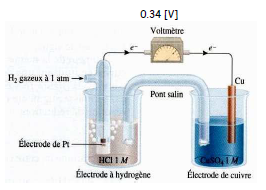
Pile hydrogène - cuivre
 |
 |
|---|---|
Schéma de la pile hydrogène - cuivre |
Dessin de la pile hydrogène - cuivre |
Dans cette pile, les concentrations des solutions sont de $1\,\mathrm{mol/L}$ et la pression de l'hydrogène de $1\,\mathrm{atm}$ à $25^{\circ}\mathrm{C}$. Ce sont les conditions standard.
À l'aide d'un voltmètre, on mesure une différence de potentiel de $+ 0,34\,\mathrm{[V]}$.
La borne négative du voltmètre est reliée à la demi-pile $\ce{2 H+/H2}$.
Puisque le potentiel du couple $\ce{2 H+/H2}$, est fixé arbitrairement à $0,00\,\mathrm{[V]}$, on dira que le potentiel de réduction standard ($E^{\circ}_{red}$) du couple $\ce{Cu^2+/Cu}$ est de $+ 0,34\,\mathrm{[V]}$.
- l'hydrogène s'oxyde : $\ce{H2 - 2 e -> 2 H+}$ (borne négative)
- le cuivre se réduit : $\ce{Cu^2+ + 2 e -> Cu}$ (borne positive)
L'électrode sur laquelle a lieu l'oxydation s'appelle l'anode.
L'électrode sur laquelle a lieu la réduction s'appelle la cathode.
Remarques :
- L'utilisation d'une électrode à hydrogène étant délicate, on préfère souvent utiliser comme électrode de référence l'électrode au calomel ($\ce{Hg2Cl2}$ ; $\ce{Hg2^{2+}/2Hg}$ dont le $E^{\circ}_{red}$ est de $+ 0,24\,\mathrm{[V]}$ selon $\ce{Hg2_{\mathrm{(aq)}}^{2+} + 2e -> 2Hg_{\mathrm{(l)}} }$ ou l'électrode au chlorure d'argent ($\ce{AgCl}$).
- Le fil de platine, dans la demi-pile à hydrogène, ne sert qu'au transport des électrons.
Le pont sert au transport des ions.
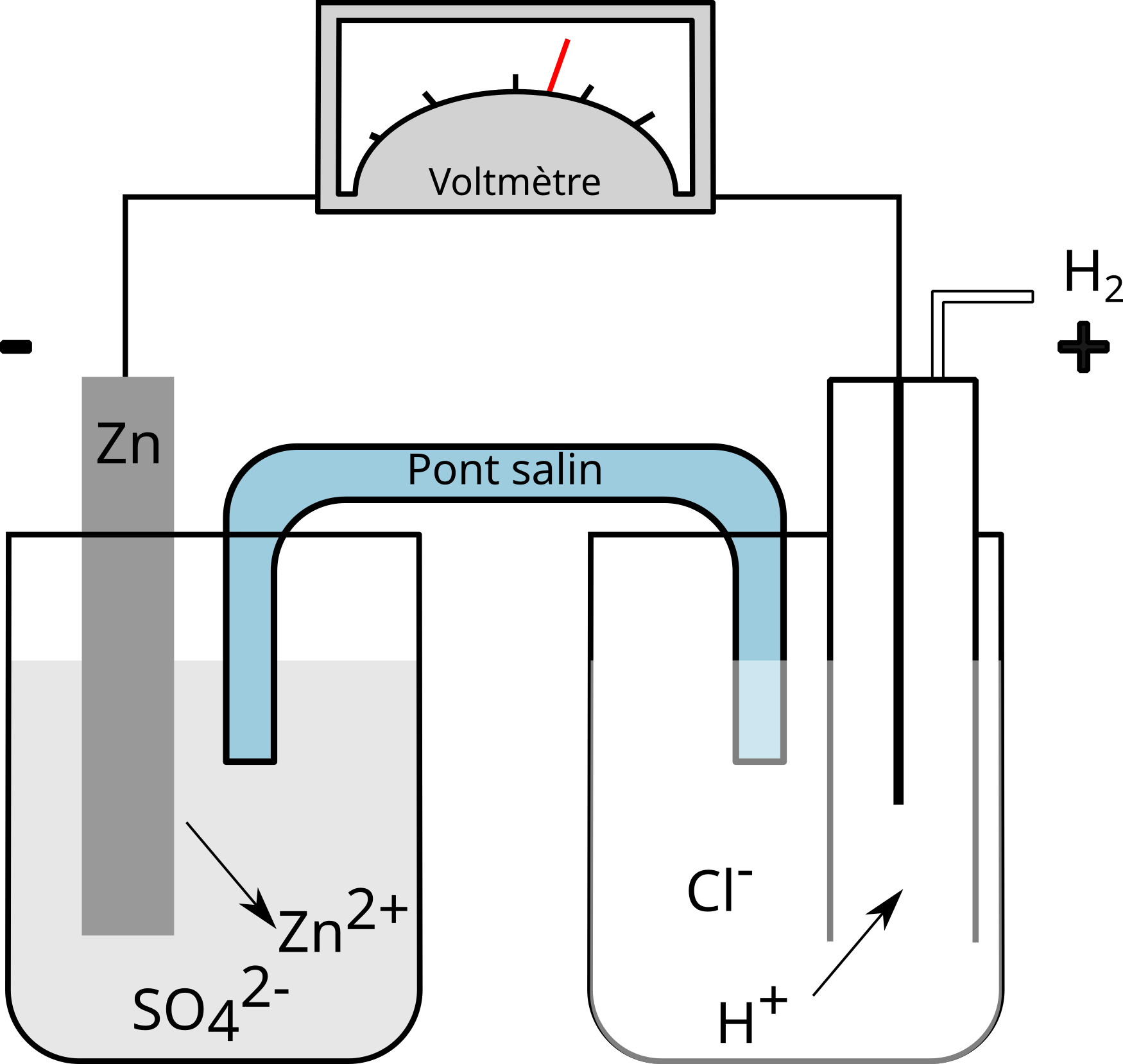
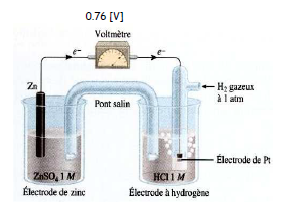
Pile hydrogène - zinc
 |
 |
|---|---|
Schéma de la pile hydrogène - zinc |
Dessin de la pile hydrogène - zinc |
Dans cette pile, les conditions sont standard également. À l'aide d'un voltmètre, dont la borne négative est reliée à la demi-pile $\ce{2 H+/H2}$, on mesure une différence de potentiel de $- 0,76\,\mathrm{[V]}$. On dira que le potentiel de réduction standard (E°red) du couple $\ce{Zn^2+/Zn}$ est de $- 0,76\,\mathrm{[V]}$.
Dans cette pile :
- le zinc s'oxyde : $\ce{Zn - 2 e -> Zn^2+}$ (borne négative)
- l'hydrogène se réduit : $\ce{2 H+ + 2 e -> H2}$ (borne positive)
Pile Daniell : cuivre - zinc
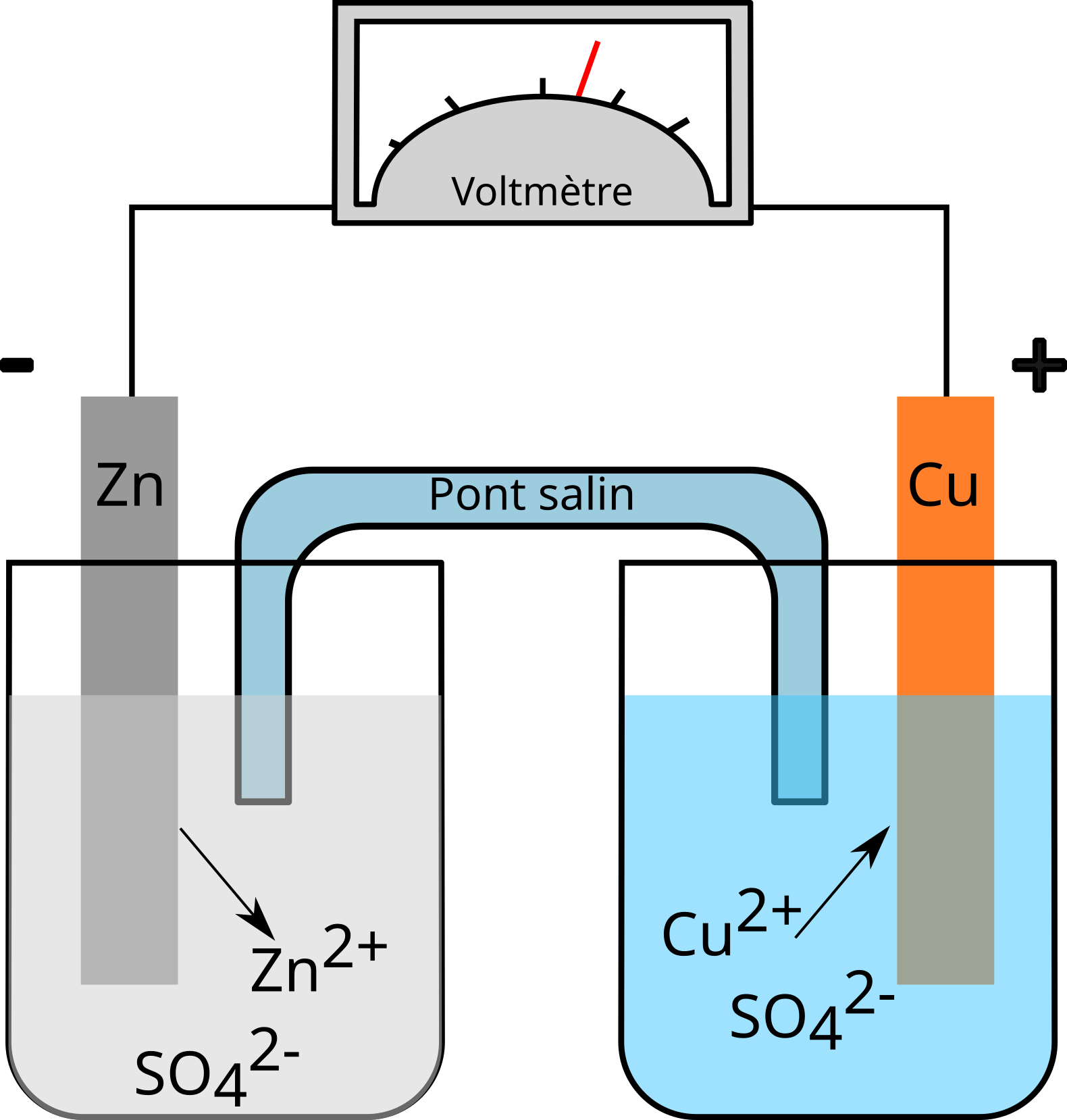 |
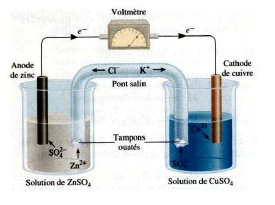 |
|---|---|
Schéma de la pile Daniell, cuivre - zinc |
Dessin de la pile Daniell, cuivre - zinc |
Lorsqu'on associe, dans les conditions standard, une demi-pile $\ce{Cu^2+/Cu}$ avec une demi-pile $\ce{Zn^2+/Zn}$, on peut prévoir soit en consultant l'échelle des $E^{\circ}_{red}$, soit en observant le signe des électrodes que le zinc s'oxyde et le cuivre se réduit.
Fonctionnement :
Les électrons produits à l'électrode de zinc (borne -) passent de cette électrode à l'autre électrode (borne +) via le conducteur métallique. Le $\ce{Cu^2+ }$ se réduit en $\ce{Cu}$ et se dépose sur la plaque de cuivre, alors que le zinc s'oxyde en $\ce{Zn^2+}$ et passe en solution, la plaque de zinc diminue. Dans le compartiment de zinc, il y a formation d'ions $\ce{Zn^2+}$ , il n'y a pas assez de $\ce{SO4^2-}$.
Dans le compartiment de cuivre, il y a disparition d'ions $\ce{Cu^2+}$, il y a trop de $\ce{SO4^2-}$. Pour la neutralité des charges, les anions $\ce{SO4^2-}$ migrent dans le compartiment de zinc à travers le pont ionique. Ainsi, la pile fonctionne grâce à la circulation continue d'électrons par le circuit électrique et d'ions sulfate par le pont ionique.
La réaction globale étant : $\ce{Zn + Cu^2+ ⇌ Zn^2+ + Cu}$
La différence de potentiel, mesurée dans les conditions standard (∆E°) ou force électromotrice standard ($f.e.m._{st}$) est de $1,1\,\mathrm{[V]}$. Elle est égale à la différence des $E^{\circ}_{red}$:
$$ f.e.m. =\Delta E^{\circ}= E^{\circ}_{cathode}-E^{\circ}_{anode} $$
$$ f.e.m.=0,34 - (-0,76)=1,1\,\mathrm{V} $$
Pile quelconque
En associant deux demi-piles quelconques, on pourra, comme pour la pile Daniell, prévoir les réactions ainsi que la $f.e.m._{st}$.
Mais, si l'on n'est pas dans les conditions standard, on mesurera, une $f.e.m.$ (ou $∆E$ = différence de potentiel). Dans ce cas, il faudra calculer la valeur de chacun des potentiels de réduction ($E$) à l'aide de la formule de Nernst ($1864 - 1941$) :
qui appliquée à la relation $\ce{a ox + n e^- ⇌ b red}$ se lit: $$ E=E^{\circ}+\frac{RT}{nF}\cdot\log\frac{[\mathrm{ox}]^a}{[\mathrm{red}]^b}=E^{\circ}+\frac{T}{n}\cdot1.98\times 10^{-4}\cdot\log\frac{[\mathrm{ox}]^a}{[\mathrm{red}]^b} $$
| $n$ = nombre d'$\ce{e^-}$ échangé | $F$ = constante de faraday ($96500$ coulomb) | R = constante des gaz parfait ($8,31\,\mathrm{J/(mol\cdot K)}$) |
| $T$ = température en $\mathrm{^{\circ}K}$ | $\ce{[ox]}$ = concentration de la forme oxydée | $\ce{[red]}$ = concentration de la forme réduite elle est égale à $1$ si on a une électrode métallique |
ä la température de $25^{\circ}\,\mathrm{C}$, l'équation de Nernst devient: $$ E=E^{\circ}+\frac{0,059}{n}\log\frac{[\ce{ox}]^a}{[\ce{red}]^b} $$ Exemple
Dans une pile Daniell dans laquelle $\ce{[Zn^2+] = 0,01 mol/L}$ et $\ce{[Cu^2+] = 0,2 mol/L}$.
-
$E=E^{\circ}+\frac{0,059}{n}\log\frac{[\ce{Cu^2+}]}{[\ce{Cu}]}= 0,34 + 0,059/2 \cdot \log (0,2) = 0,32\,[V]$
-
$E=E^{\circ}+\frac{0,059}{n}\log\frac{[\ce{Zn^2+}]}{[\ce{Zn}]}=- 0,76 + 0,059/2 \cdot \log (0,01) = - 0,82\,[V]$
-
$f.e.m. =\Delta E^{\circ}= E^{\circ}_{cathode}-E^{\circ}_{anode} = 0,32 - (- 0,82) = 1,14\,[V]$
Divers types de piles
La pile de Volta
 |
La pile de Volta |
Il s'agit de la première pile construite par Volta en 1800. Il s'agissait d'un empilement de rondelles de cuivre et de zinc, séparées par du feutre imbibé d'une solution acide.
Un exemplaire est présenté à Paris au Musée des Arts et Métiers.
Réaction globale : $\ce{Zn + 2 H+ ⇌ Zn^2+ + H2}$
Faites un croquis en indiquant la cathode, l’anode et les réactions aux deux électrodes.
La pile Leclanché
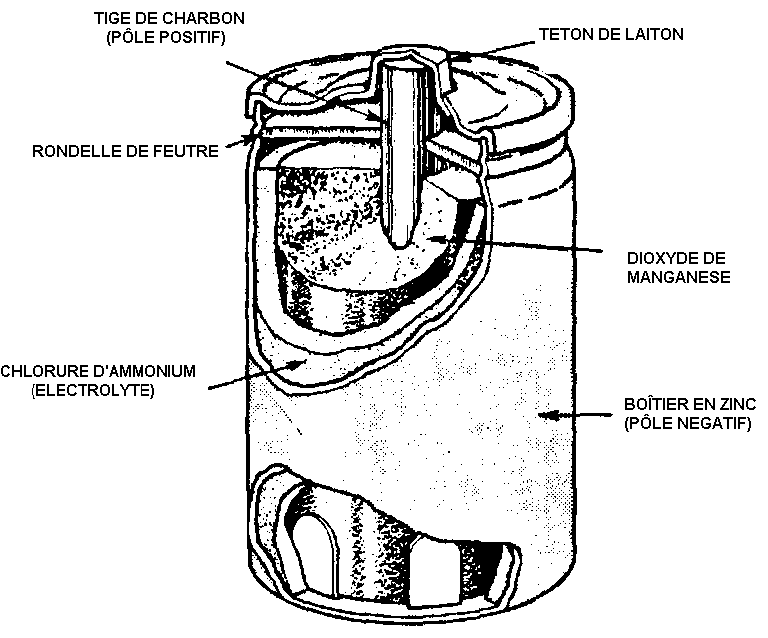 |
La pile Leclanché |
Inventée en $1868$ par Leclanché. Encore très utilisée aujourd'hui, elle a l'avantage d'être bon marché, mais sa tension varie beaucoup en fonction de la décharge. Contenant souvent un peu de mercure, elle doit être, comme toutes les piles, récupérée.
Complétez la représentation de la pile en indiquant la cathode, l’anode et les réactions aux deux électrodes.
Réaction globale : $\ce{Zn + 2 NH4Cl + 2 MnO2 ⇌ ZnCl2·2NH3 + Mn2O3 + H2O}$
La pile à l'argent
C'est la pile classique des montres et des calculatrices. Elle ne peut débiter que peu de courant, mais sa tension est en revanche très stable au cours du temps.
Doit toujours être récupérée.
Réaction globale : $\ce{Zn + Ag2O + H2O ⇌ Zn(OH)2 + 2 Ag}$
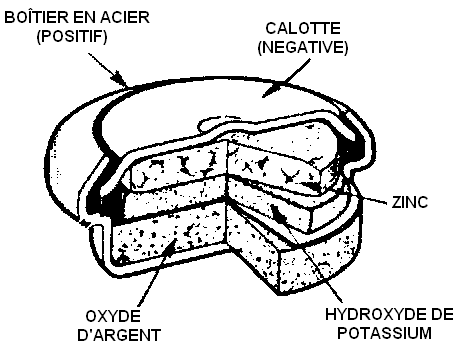 |
La pile à l'argent |
Complétez le croquis de la pile en indiquant les réactions aux deux électrodes.
L'accumulateur au plomb
Les réactions aux électrodes étant presque parfaitement réversibles, cet accumulateur est rechargeable. Son seul inconvénient est son poids ainsi que l'électrolyte liquide $\ce{H2SO4 1\,M}$. Cette pile sera discutée plus en détail dans l'annexe à ce chapitre.
Réaction globale : $\ce{Pb + PbO2 + 2 H2SO4 ⇌ 2 PbSO4 + 2 H2O}$
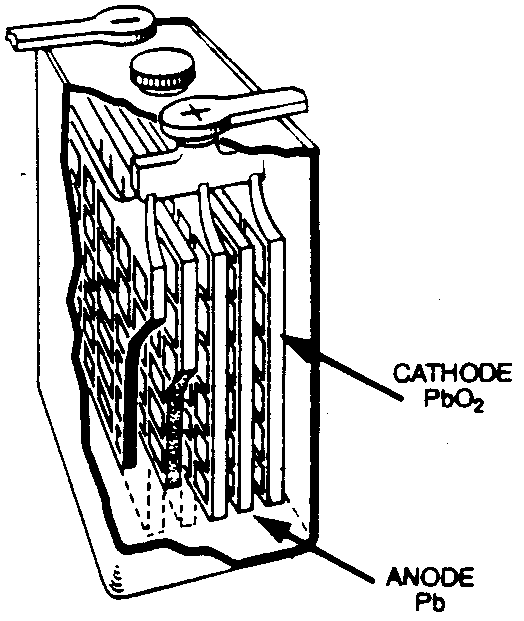 |
L'accumulateur au plomb |
Les piles électrochimiques chez les animaux
Les piles électrochimiques, également appelées bioélectrochimiques, sont des structures fascinantes présentes chez certains animaux, capables de générer de l'électricité. Ces capacités bioélectriques jouent des rôles variés allant de la défense à la communication en passant par la chasse. Les animaux les plus connus pour leurs propriétés électrogéniques sont les poissons électriques comme les anguilles électriques, les torpilles (ou raies électriques) et les poissons-chats électriques.
L'Anguille Électrique
L'anguille électrique est probablement l'exemple le plus célèbre d'animal utilisant une pile électrochimique. Elle possède des organes électriques spécialisés composés de cellules appelées électrocytes. Ces électrocytes fonctionnent de manière similaire à des piles voltaïques : en empilant ces cellules, elles génèrent des potentiels électriques individuels qui s'additionnent pour produire une décharge électrique puissante. Une anguille électrique peut produire des chocs allant jusqu'à $600$ volts, suffisamment forts pour étourdir ses proies ou se défendre contre les prédateurs.
Les Torpilles
Les torpilles, ou raies électriques, possèdent également des organes électriques. Ces organes sont situés de chaque côté de leur tête et contiennent des milliers d'électrocytes. Lorsqu'elles sont stimulées, les torpilles peuvent libérer des décharges électriques atteignant $200\,\mathrm{volts}$. Ces décharges servent à immobiliser leurs proies, facilitant ainsi la capture et la consommation. De plus, les torpilles utilisent ces décharges pour se défendre contre les menaces potentielles.
Fonctionnement des Électrocytes
Les électrocytes, cellules spécialisées présentes dans les organes électriques de ces animaux, fonctionnent de manière analogue à une pile électrochimique. Voici comment ce processus se déroule :
-
Structure des Électrocytes : Chaque électrocyte est une cellule plate capable de générer un potentiel électrique. Les électrocytes sont disposés en série, formant des colonnes au sein des organes électriques.
-
Création de Potentiel Électrique : À l'intérieur des électrocytes, il existe une distribution inégale des ions sodium $\ce{Na+}$ et potassium $\ce{K+}$. Au repos, la membrane cellulaire maintient une différence de potentiel grâce à des pompes ioniques qui transportent activement les ions $\ce{Na+}$ hors de la cellule et les ions $\ce{K+}$ à l'intérieur.
-
Activation des Électrocytes : Lorsque l'animal décide de produire une décharge électrique, des signaux nerveux provoquent l'ouverture simultanée des canaux ioniques dans les membranes des électrocytes. Ces canaux sont des protéines qui permettent le passage sélectif des ions à travers la membrane cellulaire. Cela permet aux ions ($\ce{Na+}$) de pénétrer rapidement dans la cellule et aux ions ($\ce{K+}$) de sortir, inversant temporairement le potentiel de membrane.
-
Génération de Courant Électrique : Cette inversion rapide crée une différence de potentiel électrique à travers chaque électrocyte. Comme les électrocytes sont connectés en série, les potentiels individuels s'additionnent, générant une décharge électrique cumulée qui peut atteindre plusieurs centaines de volts. Il s'agit d'un mouvement d'ions.
 |
L'électrocyte de l'anguille électrique |
Analogie avec une Pile Électrochimique
Les électrocytes peuvent être comparés à une pile électrochimique de la manière suivante :
-
Anode et Cathode : Dans une pile, l'anode est le site de l'oxydation et la cathode celui de la réduction. De même, dans un électrocyte, la membrane cellulaire agit comme une séparation entre deux moitiés où les flux d'ions créent des potentiels électriques.
-
Électrolyte : La solution ionique à l'intérieur et à l'extérieur des électrocytes fonctionne comme l'électrolyte dans une pile, permettant la conduction des ions.
-
Circulation des Ions : Les pompes ioniques et les canaux dans les électrocytes jouent un rôle similaire à celui des électrodes dans une pile, contrôlant le flux d'ions pour générer un courant.
-
Production de Potentiel : Comme dans une pile où une réaction chimique produit un potentiel électrique, l'activité des canaux ioniques dans les électrocytes crée une différence de potentiel qui peut être utilisée pour générer une décharge électrique.
Corrosion
La corrosion du fer est un phénomène électrochimique complexe qui entraîne la dégradation du fer en présence d'eau et d'oxygène, formant des oxydes de fer, communément appelés rouille. Ce processus est non seulement un problème esthétique mais aussi structurel, causant des dommages considérables aux infrastructures et aux équipements métalliques.
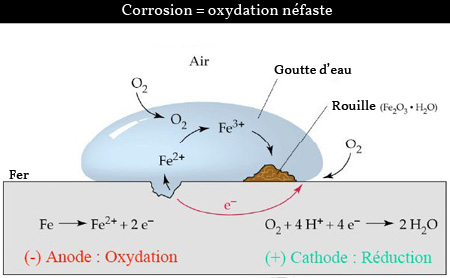 |
Le phénomène de la corrosion |
Mécanisme de la Corrosion
La corrosion du fer se déroule principalement par un mécanisme d'oxydoréduction en présence d'électrolytes tels que l'eau contenant des sels dissous. Le processus peut être décomposé en plusieurs étapes :
-
Formation de Piles Localisées : Sur la surface du fer, des zones anodiques et cathodiques se forment. La zone anodique est celle où le fer se dissout en libérant des électrons :
Anode: $\ce{Fe ⇌ Fe^2+ + 2 e^{-}}$ -
Réaction Cathodique : Les électrons libérés migrent vers la zone cathodique, comme ils le feraient dans un fil conducteur d'une pile électrochimique, où ils réduisent l'oxygène dissous dans l'eau :
Cathode: $\ce{O2 + 2 H2O + 4e^- ⇌ 4 OH^-}$ -
Formation de la Rouille : Les ions ferreux ($\ce{Fe}^{2+}$) réagissent avec les ions hydroxydes ($\ce{OH}^-$) pour former de l'hydroxyde de fer, qui s'oxyde ensuite pour former de la rouille, un mélange d'oxydes et d'hydroxydes de fer :
$\ce{4 Fe^2+ + 6 H2O + 3 O2 -> 4 Fe(OH)3}$
L'hydroxyde de fer (III) se déshydrate et se transforme en oxyde de fer (III), $\ce{Fe2O3}$, également connu sous le nom de rouille.
Facteurs Influant sur la Corrosion
La vitesse et l'intensité de la corrosion dépendent de plusieurs facteurs :
-
Présence d'Électrolytes : L'eau, surtout lorsqu'elle contient des sels dissous (comme dans l'eau de mer), facilite la conduction des ions et accélère la corrosion. Elle joue le rôle d'un pont électrolytique. L'acier en effet ne rouille pas dans un milieu sec.
-
Concentration en Oxygène : Un niveau élevé d'oxygène dissous intensifie la réaction cathodique, augmentant ainsi la corrosion.
-
pH de l'Environnement : Un environnement acide accélère la dissolution anodique du fer.
-
Température : Une température plus élevée augmente la vitesse des réactions électrochimiques, donc la corrosion.
Exercices SERIE Electrochimie
Quel est l'oxydant le plus énergique (fort), et le réducteur le plus fort selon la table des potentiels ?
Est-ce facile d'attaquer (d’oxyder) les métaux précieux, pourquoi ?
Dans quel cas une réaction peut-elle avoir lieu ?
dichlore et ion iodure
diiode et ion chlorure
ion chlorure et ion iodure
On veut conserver une solution de sulfate de plomb $\ce{PbSO4}$. Peut-on le faire indifféremment dans des récipients en $\ce{Zn}$, en $\ce{Al}$, en cuivre, ou en nickel ?
Peut-on relier les conduites d'eau chaude de chauffage en cuivre directement à un radiateur en acier ($\ce{Fe}$) ?
Vous portez des bijoux en argent. Pouvez-vous travailler avec des solutions d'acide nitrique ($\ce{HNO3}$) ?
Répondez aux questions suivantes:
Quels sont les métaux qui donnent un dégagement de dihydrogène ($\ce{H2}$) s'ils sont en contact avec un acide ?
Qu'arrive-t-il si vous laissez tomber votre bague en platine dans une solution d'acide chlorhydrique ?
Et si vous laissez tomber par mégarde une plaque de zinc dans de l'acide nitrique ?
Écrivez les réactions d'oxydoréduction réalisables à partir des couples oxred suivants:
| $\ce{Al^3+/Al^0}$ | $\ce{Cr^3+/Cr^0}\qquad$ pour le chrome $E°_{red} = -0,71 [V]$ | |
| $\ce{Cu^2+/Cu^0}$ | $\ce{Br2/2 Br^-}$ | |
| $\ce{Fe^3+/Fe^2+}$ | $\ce{Sn^4+/Sn^2+}$ |
À l'aide de la liste de potentiels, écrivez les réactions d'oxydoréduction complètes et équilibrées réalisables à partir des couples oxred suivants:
| $\ce{Ce^4+/Ce^3+}$ | $\ce{Fe^3+/Fe^2+}$ | en milieu sulfurique ($\ce{H2SO4}$) | |
| $\ce{Au^3+/Au^0}$ | $\ce{Fe^3+/Fe^2+}$ | en milieu chlorhydrique ($\ce{HCl}$) | |
| $\ce{MnO4^{-}/Mn^2+}$ | $\ce{Cl2/ 2 Cl^-}$ | $\ce{MnO4-}$ est sous forme de permanganate de potassium (KMnO4). Milieu acide chlorhydrique |
|
| $\ce{IO3^{-}/I^-}$ | $\ce{Fe^3+/Fe^2+}$ | Ion associé au $\ce{Fe}$ : $\ce{Cl^-}$ ; ion associé au iode : $\ce{K+}$ |
Soient deux couples oxred participant aux réactions d'électrodes : $\ce{NO3- / NO}$ et $\ce{Sn^2+ / Sn}$
Précisez la composition de la solution électrolytique de chaque compartiment et celle des électrodes. (Note : $\ce{NO}$ est un gaz)
Donnez les réactions à l'anode et à la cathode.
Spécifiez les bornes positive et négative.
Calculez la $f.e.m._{st}$ de cette pile.
Indiquez le sens du mouvement des électrons et celui des ions.
Soit une pile constituée d'une demi-pile $\ce{Ni^2+/Ni}$ associée à une demi-pile $\ce{Co^2+/Co}$.
Faites un schéma annoté de la pile.
Ecrivez les réactions se produisant aux électrodes.
Calculez la $f.e.m._{st}$ de la pile.
Calculez la $f.e.m.$ de la pile lorsque : $\ce{[Co^2+] = 0,1\,mol/L}$ et $\ce{[Ni^2+] = 0,5\,mol/L}$.
On associe une demi-pile $\ce{Pt : Fe^3+/Fe^2+}$ à une demi-pile $\ce{Pt : I3^{-}/3 I^{-}}$ dont le $E°red = + 0,536 [V]$.
Faites un schéma de la pile.
Ecrivez les réactions se produisant aux électrodes.
Quelle est la $f.e.m._{st}$ de la pile ?
Quelle est la fem de la pile lorsque:
| $\ce{[Fe^3+] = 0,1 mol/L}$ | $\ce{[Fe^2+] = 0,2 mol/L}$ | $\ce{[I^{-}] = 0,3 mol/L}$ | $\ce{[I3^{-}] = 0,4 mol/L}$ |
On associe une demi-pile $\ce{Co^2+/Co}$ à une demi-pile à hydrogène.
Ecrivez les réactions se produisant aux électrodes.
Quelle est la fem de la pile lorsque : $\ce{[Co3(PO4)2 ] = 0,05 mol/L}$ et que le $\ce{pH}$ de l'électrode à hydrogène est de $2,5$.
Le potentiel du couple $\ce{O2, H+/H2O}$ au $\ce{pH = 7}$ est de $0,81\,[V]$. Peut-on garder des ustensiles en fer dans cette atmosphère ?
Faut-il plonger une plaque d'aluminium dans une solution contenant des ions $\ce{Hg^2+}$ ou des gouttes de mercure dans une solution contenant des ions $\ce{Al^3+}$ pour qu'il y ait réaction spontanée ?
On associe une électrode de zinc à une électrode au calomel saturé. Quelle est la fem de cette pile si la concentration des ions $\ce{Zn^2+ = 0,5 mol/L}$ ?
On associe une électrode de cuivre plongée dans une solution $\ce{1 mol/L\,CuSO4}$ à une électrode d'hydrogène. La fem étant de $0,88\,[V]$, quel est le $\ce{pH}$ de la solution dont est formée l'électrode d'hydrogène ? (pression $\ce{H2 = 1 atm}$)
Que va t'il se passer, si l'on plonge successivement dans une solution neutre de $\ce{Pb(NO3)2}$ :
un morceau de $\ce{Zn}$
un morceau de $\ce{Cu}$
un morceau de $\ce{Sn}$
Ces réactions sont-elles possibles ? Pourquoi ?
$\ce{Li + 2 H2O -> 2 LiOH + H2}$
$\ce{CdCl2 + 2 HI + S -> CdS + I2 + 2 HCl}$
Utilisez le tableau des potentiels standards de réduction pour choisir un réactif capable d’effectuer les réactions suivantes :
oxydation de $\ce{Br^{–}}$ en $\ce{Br2}$ mais non celle de $\ce{Cl^{–}}$ en $\ce{Cl2}$
oxydation de $\ce{Mn}$ en $\ce{Mn^2+}$ mais non celle de $\ce{Ni}$ en $\ce{Ni^2+}$
réduction de $\ce{Fe^3+}$ en $\ce{Fe^2+}$ mais non celle de $\ce{Fe^2+}$ en $\ce{Fe}$
Une pile électrochimique est composée d’une électrode d’argent plongée dans une solution de ions $\ce{Ag+}$ de concentration $1\,\mathrm{M}$.
Quel est le potentiel de cette pile si l’électrode de cuivre est plongée dans une solution pour laquelle $\ce{[Cu^2+] = 1,3\times 10^{–5}\,mol/L}$ ?
On plonge l’électrode de cuivre dans une solution de $\ce{Cu^2+}$ de concentration inconnue et on mesure un potentiel de $0,58\,\mathrm{V}$. Calculez la concentration de la solution inconnue.
Soient les réactions de réduction :
$\ce{Fe^3+ + 1 e– -> Fe^2+}$
$\ce{Cr2O7^2– + 14 H+ + 6 e– -> 2 Cr^3+ + 7 H2O \qquad E0 = +1,33 V}$