Piles commerciales
Nous verrons ici quelques exemples de pile d'usage courant, qui mettent en pratique la théorie sur l'électrochimie, mais aussi sur l'électrolyse.
Lorsqu'on alimente un dispositif électrique à l'aide d'une pile, on transforme de l'énergie chimique en électrique: ici, on exploite les bases théoriques de l'électrochimie.
Lorsqu'on recharge une batterie, on emploie, comme lors d'un processus d'électrolyse, une source d'électricité pour rendre la batterie à nouveau fonctionnelle.
Batteries primaires
Une batterie primaire, appelée aussi pile, produit de l'électricité à partir de produits chimiques qui s'oxydent et d'autres qui se réduisent. Il s'agit d'exemples que nous avons travaillés dans la théorie. A noter que ce type de batterie cesse de fonctionner lorsque la réaction d'oxydoréduction atteint l'équilibre et qu'elle ne peut pas être rechargée.
La pile Leclanché, inventée par le Belge Georges Leclanché, est un exemple célèbre de batterie primaire. A signaler que Leclanché désigne également une entreprise électrique suisse fondée en $1909$ à Yverdon-les-Bains et encore existante aujourd'hui.
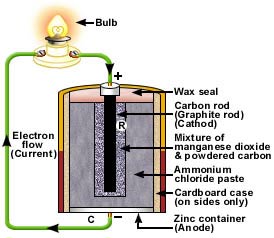
La pile Leclanché.
Les réactions se produisant dans une pile Leclanché sont les suivantes:
\begin{align} \text{Anode:}\qquad \ce{&Zn} - 2\,\text{e}^- \ce{-> Zn^2+} \\ \text{Cathode:} \qquad \ce{&2MnO2 + 2NH4+} + 2\,\text{e}^- \ce{-> Mn2O3 + 2NH3 + H2O} \\ \end{align}
Accumulateurs
Les accumulateurs, appelés aussi batteries secondaires, peuvent être rechargés. Nous sommes entourés de ce type de batterie: on en trouve dans la plupart des dispositifs électriques d'aujourd'hui et dans les automobiles.
Pour recharger une batterie secondaire, il faut une source d'énergie électrique nécessaire à ramener une réaction d'oxydoréaction loin de l'équilibre chimique.
Une fois rechargée, la batterie pourra à nouveau générer de l'électricité jusqu'à l'équilibre.
Accumulateur au plomb
A la décharge, les deux électrodes se sulfatent et l'électrolyte est consommé ( les ions $\ce{SO4^2-}$ vont sur les électrodes). L'oxygène $\ce{O^2-}$ libéré par l'électrode positive s'unit aux ions $\ce{H+}$ en solution pour former de l'eau. Si la décharge est totale, l'électrolyte sera remplacé par de l'eau distillée.
Voici les équations se déroulant aux électrodes lors de la décharge: on observe que l'acide sulfurique est consommée durant ce processus.
\begin{align} \text{Anode:}\qquad \ce{&Pb + HSO4^-} - 2\,\text{e}^- \ce{-> PbSO4 + H+} \\ \text{Cathode:} \qquad \ce{&PbO2 + 3H+ + HSO4^-} + 2\,\text{e}^- \ce{-> PbSO4 + 2H2O} \\ \end{align}
Lors de la recharge, les réactions s'inversent et de l'acide sulfurique se reforme1. On peut donc évaluer l'état de la batterie par la concentration de l'acide sulfurique.
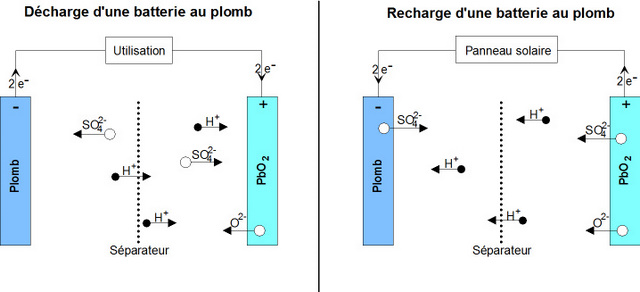
Charge et décharge d'un accumulateur au plomb: le panneau solaire n'est qu'un exemple de source d'alimentation électrique permettant de recharger l'accumulateur.
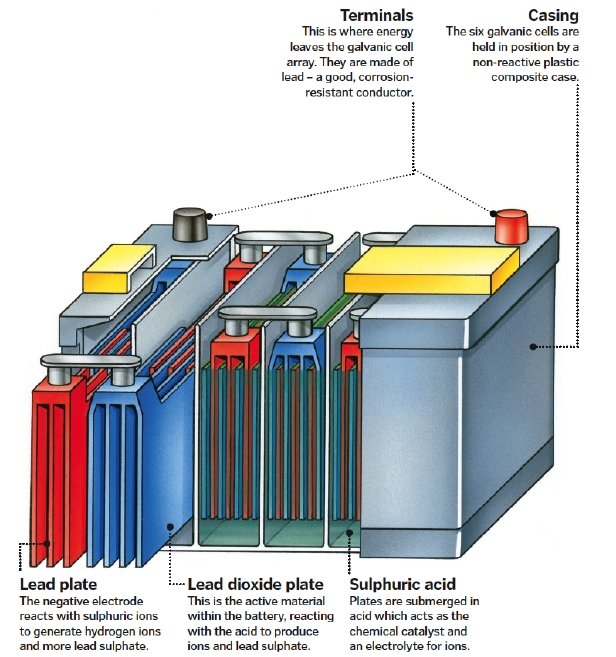
La batterie au plomb d'une automobile est un ensemble d'accumulateurs au plomb-acide sulfurique raccordés en série. La membrane entre les deux compartiments est constituée d'un matériau poreux, assurant à la fois le contact, mais aussi la séparation entre les deux compartiments.
Accumulateur ion-lithium
Certains solides peuvent servir d'électrodes pour les batteries au lithium grâce à un type de réaction connu sous le nom d'intercalation. Ces solides possèdent une structure cristalline poreuse, caractérisée par de nombreux tunnels.3
Pendant la charge, l'électrode constituée d'une matrice de graphite, s'enrichit en électrons sous l'effet du courant appliqué. Les ions $\ce{Li+}$, attirés par l'électrode riche en électrons, s'insèrent alors dans la structure du graphite. Cette insertion est représentée par la formule $\ce{Li_{n}C6}$, indiquant les ions lithium intégrés dans le graphite. Notez que dans la phase de charge, l'électrode $\ce{Li_{n}C6}$ représente la cathode.
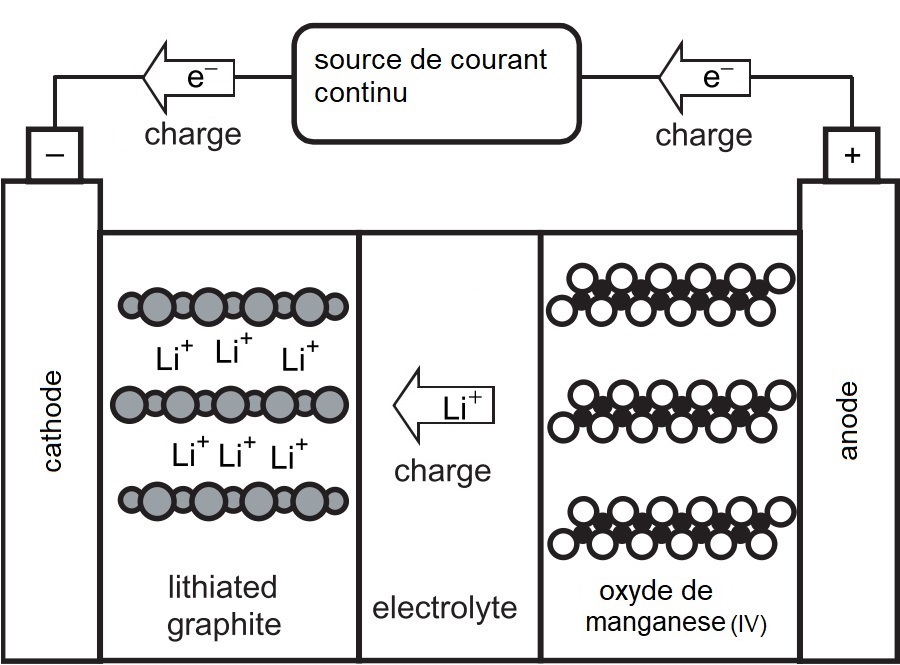
L'accumulateur ion lithium en phase de charge.
Pendant la décharge, le processus s'inverse : les électrons se déplacent vers la cathode (constituée d'oxyde de manganèse ou d'un autre métal), libérant les ions $\ce{Li+}$, qui migrent à leur tour vers la cathode.
Voici la réaction d'oxydation qui a lieu au niveau du graphite :
$$ \text{Anode:}\qquad \ce{Li_{n}C6} - \text{n}\, \text{e}^- \ce{-> \mathrm{n}\, Li+ + 6C} $$
Dans la demi-réaction cathodique, l'oxyde de manganèse devenu négatif, attire les ions $\ce{Li+}$. Le manganèse est alors réduit selon la demi-réaction suivante :
$$ \text{Cathode:}\qquad \ce{MnO2 + \mathrm{n}\, Li+} + \text{n}\,\text{e}^- \ce{-> Li_{n}MnO2} $$
Voici le schéma illustrant la décharge de la pile :
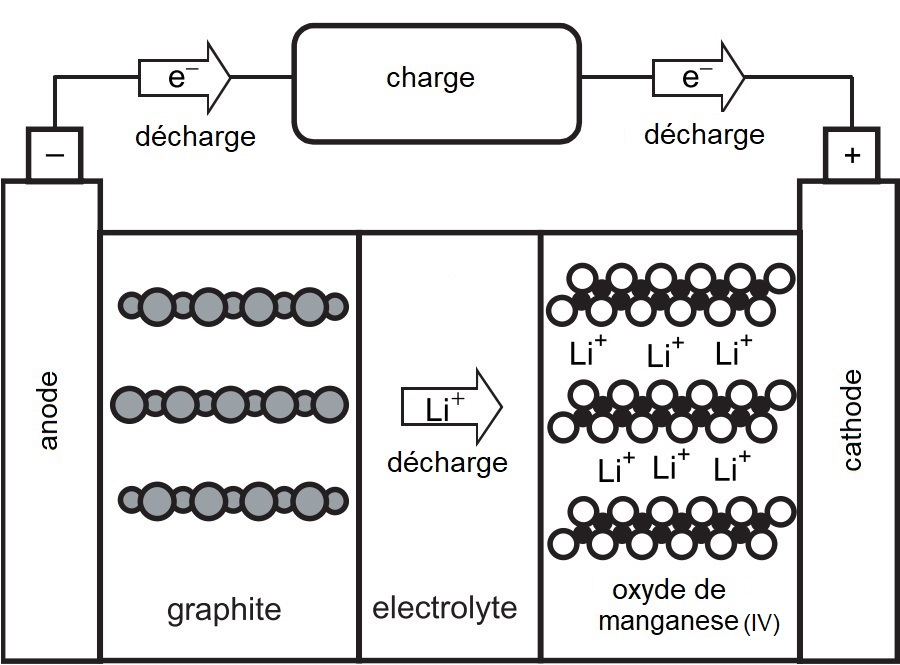
L'accumulateur ion lithium en phase de décharge: le terme charge désigne la quantité d'énergie électrique consommée par un appareil, un circuit ou un système électrique
Pile à combustible
Une pile à combustible est un générateur électrochimique d'énergie permettant de transformer directement l'énergie chimique d'un combustible (hydrogène, hydrocarbures, alcools,...) en énergie électrique sans passer par l’énergie thermique.2
La pile à combustible est l'inverse de l'électrolyse de l'eau. Ici, on supprime la source de tension, on alimente en hydrogène et oxygène et on constate l'apparition d'une tension électrique entre les deux électrodes : le dispositif est devenu un générateur électrique qui fonctionnera aussi longtemps qu'il sera alimenté. Pour cela, elle est constituée de deux électrodes (anode et cathode) recouvertes de platine, qui sert de catalyseur et séparées par un électrolyte.
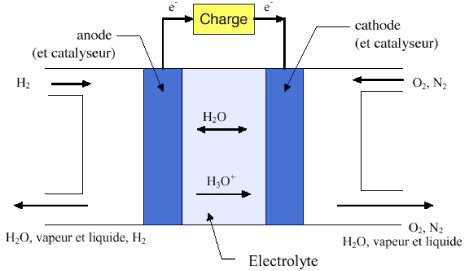
Pile à combustible.
Le combustible à base d'hydrogène $\ce{H2}$ est amené sur l'anode. Le $\ce{H2}$ se transforme en ions $\ce{H+}$ et libère des électrons. Les ions $\ce{H+}$ diffusent sur la cathode où ils réagissent avec $\ce{O2}$. Cependant cette tension ne dépasse pas $~1\,\mathrm{V}$ par cellule ; il faut donc utiliser un grand nombre de cellules en série pour obtenir la tension requise.
Les réactions aux électrodes sont les suivantes:
\begin{align} \text{Anode:}\qquad \ce{&2H2} - 4\,\text{e}^- \ce{-> 4 H+} \\ \text{Cathode:} \qquad \ce{&O2 + 4H^{+}} + 4\,\text{e}^- \ce{-> 2H2O} \\ \end{align}