Introduction à la mole
Définition de la mole
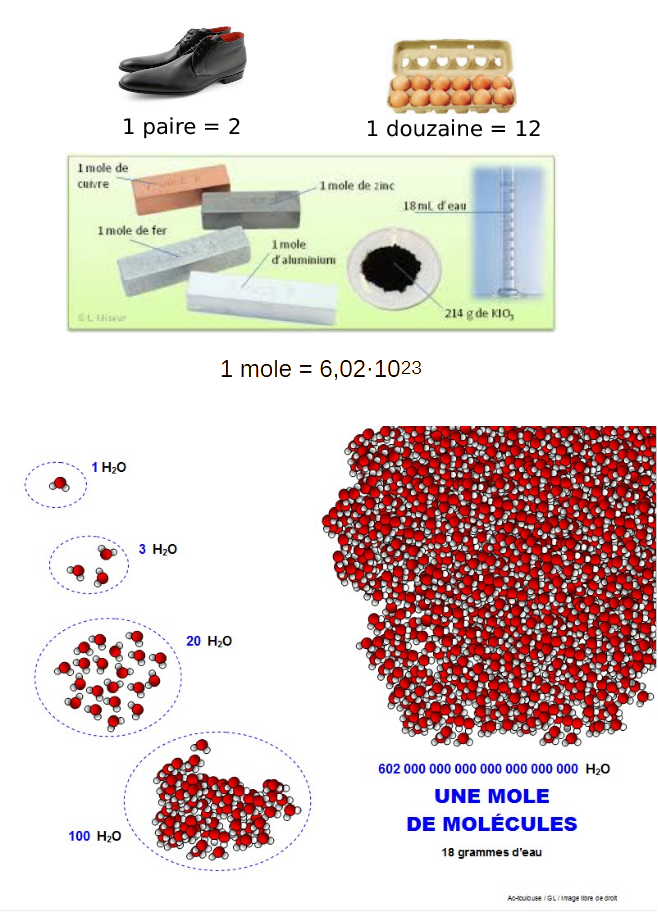 |
La mole: l'unité de mesure de quantité de matière |
Masse d'une mole d'atomes
Que vaut la masse d'une mole d'atomes ? Prenons le cas du carbone :
La réponse est $12,0 \, \text{g}$ (d'après le tableau périodique), car la masse d'une mole d'atomes de carbone est égale à la masse atomique du carbone exprimée en grammes.
| Élément | Nombre de moles d’atomes ($\ce{mol}$) | Masse ($\ce{g}$) | Nombre d’atomes |
|---|---|---|---|
| Cuivre | $1$ | $6,02 \times 10^{23}$ | |
| Fer | $22$ | ||
| Or | $8,55 \times 10^{23}$ |
La masse d’une mole est également appelée Masse Molaire.
Que vaut la masse d’un atome d’or en grammes ?
Masse d'une mole de molécules
Prenons le cas de la molécule d'eau : $\text{H}_2\text{O}$.
On additionne les masses atomiques de chaque élément, en tenant compte du nombre d'atomes.
Pour l'eau : $2 \times 1,0 + 1 \times 16,0 = 18,0 \, \text{u}$
La réponse est donc $18,0 \, \text{g}$, car la masse d'une mole de molécules d’eau est égale à la masse moléculaire de l'eau, exprimée en grammes.
| Molécule | Nombre de moles de molécules ($\ce{mol}$) | Masse ($\mathrm{g}$) | Nombre de molécules |
|---|---|---|---|
| $\ce{H2O}$ | $1$ | $6,02 \times 10^{23}$ | |
| $\ce{C6H12O6}$ | $150$ | ||
| $\ce{CO2}$ | $4,75 \times 10^{22}$ |
Que vaut la masse d’une molécule de sucre ($\ce{C6H12O6}$) en grammes ?
Exercices sur les moles
Une clé en fer a une masse de $35 \, \text{g}$, combien contient-elle d'atomes de fer ?
Un morceau de silicium a une masse de $218 \, \text{g}$, combien contient-il d'atomes de silicium ?
Un bracelet en or pur ($24$ carats !) a une masse de $196,97 \, \text{g}$. Quelle serait la masse d'un autre bracelet en argent pur, cette fois-ci, qui contiendrait le même nombre d'atomes ?
Dans $18 \, \text{g}$ d'eau, combien pourrait-on compter d'atomes d'oxygène ? Combien d'atomes d'hydrogène ?
Combien de moles y a-t-il dans $36 \, \text{g}$ d'eau ?
Nous avons $10 \, \text{g}$ de soufre et $10 \, \text{g}$ de fer. Dans lequel de ces deux échantillons, y a-t-il plus d'atomes ? Justifiez.
Quelle est la masse en grammes de $7,45 \times 10^{22}$ molécules de $\ce{C6H12O6}$ ?
Combien de molécules sont présentes en $7,10\,\mathrm{mol}$ de $\text{HC}_2\text{H}_3\text{O}_2$ ? Combien d'atomes sont présents ?
Le sulfate de thallium ($\ce{Tl2SO4}$) a autrefois été utilisé comme poison pour les rats. Déterminez si les quantités de $\ce{Tl2SO4}$ indiquées dans le tableau ci-dessous seraient suffisantes pour provoquer la mort d'un rat domestique pesant $500 \, \text{g}$, sachant qu'une quantité de $12,5 \, \text{mg}$ de ce poison suffit pour le tuer.
| Quantité de $\ce{Tl2SO4}$ | Effet sur le rat |
|---|---|
| $1,3 \times 10^{-2} \, \text{g}$ | ¤ Il survit ¤ Il meurt |
| $2,0 \times 10^{-5} \, \text{mol}$ | ¤ Il survit ¤ Il meurt |
| $1,8 \times 10^{19}$ molécules | ¤ Il survit ¤ Il meurt |