Volumétrie et pH
La volumétrie (ou titrage volumétrique), comme son nom l'indique, est une méthode d'analyse quantitative basée sur la mesure précise des volumes de solutions. Elle consiste à utiliser une solution de concentration connue (appelée titrant) afin de neutraliser une espèce contenue dans une solution inconnue. Dans un dosage acide-base, on neutralise un acide par une base (hydroxyde) ou une base (hydroxyde) par un acide, le volume de solution nécessaire à la neutralisation exacte est déterminé par le virage d’un indicateur approprié.
A quoi sert tout ça ?
A trouver la concentration de la solution inconnue: nous verrons ainsi comment il est possible de déterminer la concentration de l'acide acétique dans le vinaigre ou de l'acide citrique dans une boisson citronnée.
Les images ci-dessous montrent la pièce maîtresse de l'équipement utilisé en volumétrie:
la burette1.
A gauche, la méthode permettant de relever un volume avec précision2:

L'appareillage pour titrer une solution de concentration inconnue. Quel volume est-il indiqué sur l'image de gauche ?
Les indicateurs de $\ce{pH}$
Les indicateurs sont des composés chimiques qui changent de couleur en fonction du $\ce{pH}$. Voici quelques exemples: à noter que vous en trouverez d'autres dans les Tables CRM.
| Rouge congo | Phénolphtaléine | Bleu de bromothymol |
|---|---|---|
| bleu ($\ce{pH} < 3$) | incolore ($\ce{pH} < 8,2$) | jaune ($0 < \ce{pH} < 6$) |
| rouge ($\ce{pH} > 5,2$) | rose ($\ce{pH} > 10$) | bleu ($\ce{pH} > 7.6$) |
Le virage de couleur permet de déterminer approximativement la valeur du $\ce{pH}$ d'une solution.
Quel indicateur faut-il choisir pour mettre en évidence une neutralisation complète ?
Le point d'équivalence
Le point d'équivalence est atteint :
- quand le milieu devient neutre.
- quand on a mis autant de $\ce{H+}$ que de $\ce{OH-}$
- quand il n'y a plus de $\ce{H+}$ ni de $\ce{OH-}$ provenant de l'acide et de la base.
$\ce{HCl + NaOH -> (H+ + OH- + Na+ + Cl- ) -> H2O + Na+ + Cl- }$
Exercices:
Quel volume de $\ce{HNO3}$ $0,4\,\mathrm{mol/L}$ faut-il pour titrer $30\,\mathrm{mL}$ de $\ce{KOH}$ $0,25\,\mathrm{mol/L}$ ?
Equation : ……………………………………………………………………………
Quelle est la molarité d'une solution inconnue de $\ce{NaOH}$ , si $25\,\mathrm{mL}$ de celle-ci est titrée par $14,8\,\mathrm{mL}$ de $\ce{H2SO4}$ $0,2\,\mathrm{mol/L}$ ?
Exercices SERIE Volumétrie
Combien de millilitres de $\ce{Mg(OH)2}$ $0,3\,\mathrm{mol/L}$ faut-il pour titrer $3\,\mathrm{mL}$ de $\ce{HCl}$ $0,3\,\mathrm{mol/L}$ ?
Combien de millilitres de $\ce{H2SO4}$ $0,5\,\mathrm{mol/L}$ faut-il pour titrer $2\,\mathrm{mL}$ de $\ce{NaOH}$ $0,5\,\mathrm{mol/L}$ ?
Soit la réaction : $\ce{H2SO4 + Ba(OH)2 -> BaSO4 + 2 H2O}$.
On neutralise $25\,\mathrm{mL}$ d'acide sulfurique par $5\,\mathrm{mL}$ d'hydroxyde de baryum $2,5 \times 10^{-2} \,\mathrm{mol/L}$. Quelle est la molarité de l'acide sulfurique neutralisé ?
Soit la réaction : $\ce{2 HCl + Mg(OH)2 -> MgCl2 + 2 H2O}$
On neutralise $10\,\mathrm{mL}$ d'hydroxyde de magnésium par $12\,\mathrm{mL}$ d'acide chlorhydrique $0,2\,\mathrm{mol/L}$. Quel est le titre de l'hydroxyde de magnésium neutralisé ?
Soit la réaction : $\ce{\qquad\qquad + \qquad\qquad -> Na3PO4 + H2O}$
Complétez et équilibrez l'équation.
En sachant que l'on a neutralisé des volumes égaux d'acide et de base et que la molarité de l'acide est de $0,06\,\mathrm{mol/L}$ déterminez la molarité de la base.
Pour neutraliser une solution d'hydroxyde de sodium dont la concentration est $20\,\mathrm{g/L}$, on a utilisé $15\,\mathrm{mL}$ d'acide sulfurique $1\,\mathrm{mol/L}$.
Établissez et équilibrez l'équation.
Déterminez le volume de base neutralisé.
Calculez le titre d'une solution de $\ce{H2SO4}$ sachant qu'il a fallu $25\,\mathrm{mL}$ de $\ce{NaOH}$ $0,1\,\mathrm{mol/L}$ pour neutraliser $5\,\mathrm{mL}$ de cette solution.
Quelle masse de $\ce{NaOH}$ y a-t-il dans $10\,\mathrm{mL}$ d'une solution inconnue si $20\,\mathrm{mL}$ de $\ce{HCl}$ $0,5\,\mathrm{mol/L}$ ont permis de titrer cette solution?
À l’aide du schéma ci-dessous, répondez aux questions (voir image : les $10\,\mathrm{mL}$ de $\ce{Ca(OH)2}$ ont permis d'atteindre le point d'équivalence = virage de l’indicateur coloré):
Combien de millilitres de $\ce{HCl}$ avions-nous au départ?
Quelles sont les particules présentes dans le bécher quand on a mis :
- $0\,\mathrm{mL}$ de $\ce{Ca(OH)2}$
- $10\,\mathrm{mL}$ de $\ce{Ca(OH)2}$
- $15\,\mathrm{mL}$ de $\ce{Ca(OH)2}$
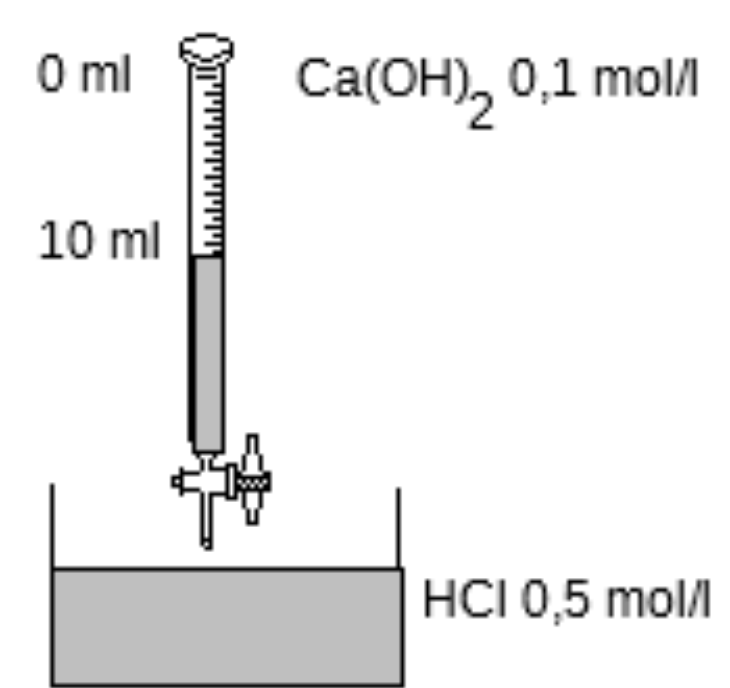
Titrage d'une solution acide par du $\ce{Ca(OH)2}$.
Quelle est la molarité d'une solution de $\ce{Al(OH)3}$ dont $10\,\mathrm{mL}$ ont été neutralisés par $30\,\mathrm{mL}$ de $\ce{HCl}$ $2 \times 10^{-2} \,\mathrm{mol/L}$.
Quel volume de $\ce{NaOH}$ $0,1\,\mathrm{mol/L}$ doit-on utiliser pour neutraliser $10\,\mathrm{mL}$ d'une solution contenant $1,96 \times 10^{-2}\,\mathrm{g}$ de $\ce{H2SO4}$ ?
Le volume de $\ce{NaOH}$ pour neutraliser cette même masse d'acide serait-il différent si elle se trouvait dans $20\,\mathrm{mL}$ de solution au lieu de $10$ ? Justifiez.
Pour neutraliser $15\,\mathrm{mL}$ de $\ce{Ba(OH)2}$, on a utilisé $20\,\mathrm{mL}$ de $\ce{HCl}$ $0,2\,\mathrm{mol/L}$.
Quelle est la molarité de l'hydroxyde?
Quelles sont les particules (ions ou molécules) présentes dans le bécher quand on a ajouté $25\,\mathrm{mL}$ de $\ce{HCl}$ ?
Comment voit-on pratiquement la fin de la réaction?
On mélange $20\,\mathrm{mL}$ de $\ce{HCl}$ $0,1\,\mathrm{mol/L}$ à $15\,\mathrm{mL}$ de $\ce{NaOH}$ $0,15\,\mathrm{mol/L}$.
Le $\ce{pH}$ sera-t-il basique ou acide ? Justifiez.
En fonction de la réponse à la question a), déterminez la concentration en ion $\ce{H+}$ ou $\ce{OH-}$.
Une boisson est dosée (=titrée) afin de déterminer le titre d'acide phosphorique ($\ce{H3PO4}$) présent.
Le volume testé de boisson est de $10\,\mathrm{mL}$ et le titrant employé est du $\ce{NaOH}$ $0,05\,\mathrm{M}$. Sachant que $5,4\,\mathrm{mL}$ de $\ce{NaOH}$ $0,05\,\mathrm{M}$ ont été nécessaires pour provoquer le virage de l’indicateur de $\ce{pH}$ (= neutralisation complète), posez l'équation chimique équilibrée de la neutralisation et déterminez ensuite le titre d'$\ce{H3PO4}$.
Le $\ce{pH}$
L'échelle de $\ce{pH}$.
Le $\ce{pH}$ est une mesure de l'acidité d'une solution. C'est donc une fonction de la concentration en ions $\ce{H+}$ = $\ce{[ H+ ]}$. De même, on peut définir le $\ce{pOH}$ comme une fonction de la concentration en ions $\ce{OH-}$. Le $\ce{pH}$ est souvent employé dans la vie courante : le logarithme permet d’éliminer la puissance de $10$ et d’obtenir un chiffre plus facile à retenir.
| Milieu acide | Milieu basique |
|---|---|
| les ions $\ce{H+}$ sont dominants | les ions $\ce{OH-}$ sont dominants |
| $\ce{pH}=-log(\ce{[H+ ]})$ | $\ce{pOH}=-log(\ce{[OH- ]})$ |
Conversion: du $\ce{pOH}$ au $\ce{pH}$
On utilise rarement le $\ce{pOH}$.
Comment passer alors du $\ce{pOH}$ au $\ce{pH}$ ?
$$ \ce{pH}=14 - \ce{pOH} $$
Conversion: du $\ce{pH}$ à $\ce{[H+]}$
Comment passer du $\ce{pH}$ à la concentration en $\ce{H+}$ ?
$$ \ce{[H+ ]}=10^{-\ce{pH}} $$
Conversion: de $\ce{[H+ ]}$ à $\ce{[OH- ]}$
Comment passer de la concentration en $\ce{H+}$ à la concentration en $\ce{OH-}$ ?
$$ \ce{[OH- ]}=\frac{10^{-14}}{\ce{[H+ ]}} $$
Noter que ces formules sont données dans les Tables CRM
(index analytique : chercher le mot « $\ce{pH}$ » ).
L'acidification des océans
Le dioxyde de carbone ($\ce{CO2 }$) peut se dissoudre dans l’eau de mer: ceci semblerait un point positif, car la quantité de dioxyde de carbone dans l’atmosphère en résulterait réduite. Cependant, le $\ce{CO2 }$ peut aussi causer l'acidification des océans, diminuant ainsi l’alcalinité (=basicité) de l’eau de mer, processus qui s’accroît avec l’augmentation du niveau de $\ce{CO2 }$ produit par les activités humaines.
Les projections actuelles suggèrent que le $\ce{pH}$ moyen à la surface de l'océan chutera à environ $7,7$ d'ici $2100$, une diminution qui représenterait une augmentation d'environ $150\%$ de l'acidité par rapport au niveau actuel 3.
Pourquoi alors se préoccupe-t-on de l'acidité des océans accrue par le $\ce{CO2 }$ ?
La réponse se trouve dans l'image ci-dessous.

L'acidification des océans est susceptible d'impacter toutes les espèces marines mais les organismes calcifiants y sont les plus sensibles.
Exercice:
Dans le site3, on affirme qu'une diminution de $0,1$ unités de $\ce{pH}$ représente une augmentation de l'acidité de $25\%$. Comment peut-on le prouver ?
L'échelle de $\ce{pH}$
L'image ci-dessous est tirée de l'excellente collection d'infographies créées par Andy Brunning 4. Notez que les $\ce{pH}$ négatifs comme les $\ce{pH}$ supérieurs à $14$ sont possibles et présents en nature. On citera, par exemple, certaines sources d'eau proches de volcans qui ont un $\ce{pH}$ mesuré inférieur à $0$.
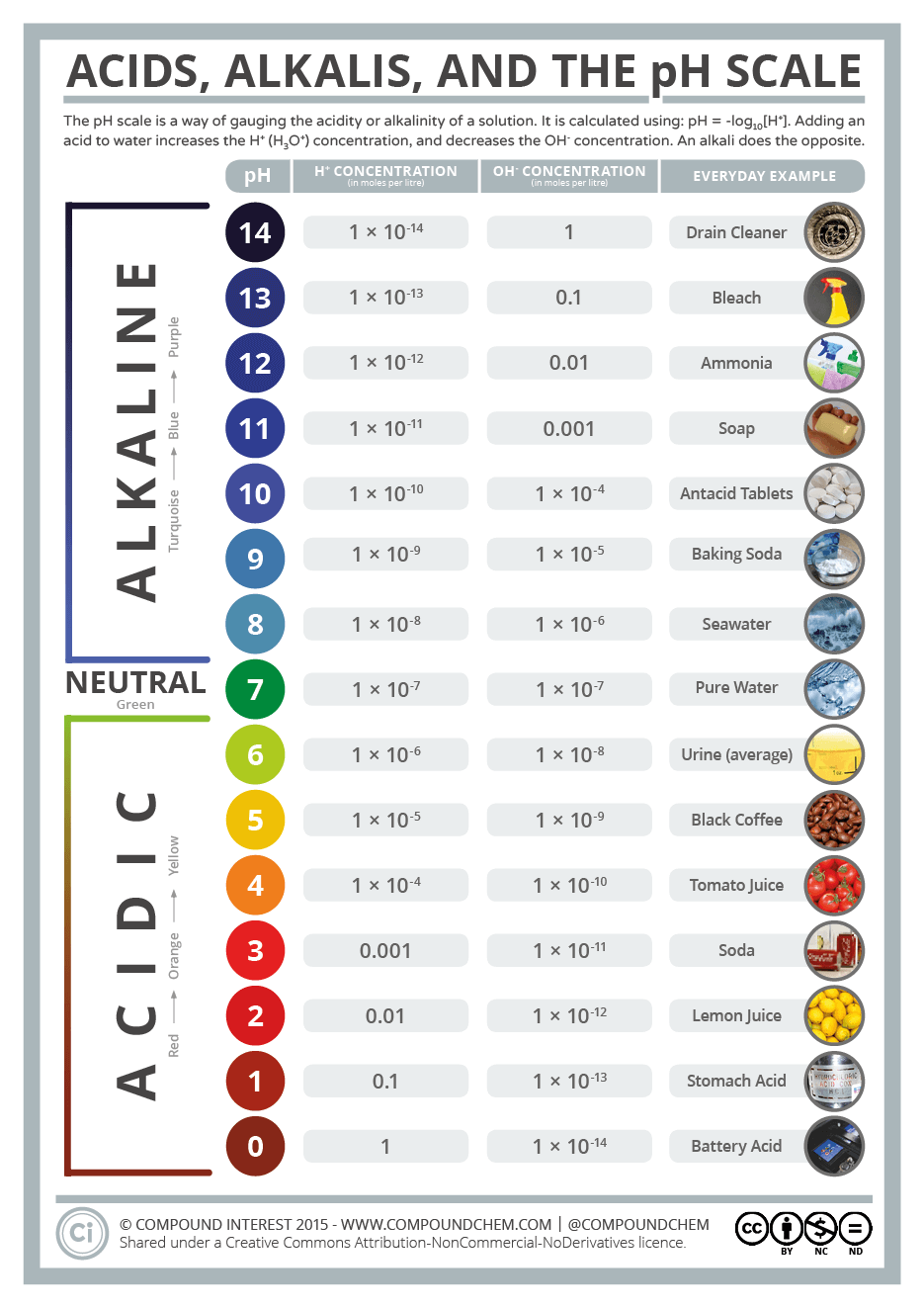
Echelle de pH et produits courants.
Exercices SERIE $\ce{pH}$
Que devient le $\ce{pH}$ si on ajoute $90\,\mathrm{mL}$ d'eau à $10\,\mathrm{mL}$ d'une solution acide dont le $\ce{pH}$ est $0,3$ ?
Que devient le $\ce{pH}$ d'une solution de $\ce{HCl}$ dont le $\ce{pH}$ est $2$ si on la dilue $10$ fois (= le volume devient $10$ fois plus grand)?
Quel est le $\ce{pH}$ d'un mélange de $100\,\mathrm{mL}$ de $\ce{H2SO4}$ $0,1\,\mathrm{mol/L}$ avec $300\,\mathrm{mL}$ de $\ce{HCl}$ $0,3\,\mathrm{mol/L}$ ?
Quel est le $\ce{pH}$ d'un mélange de $100\,\mathrm{mL}$ de $\ce{H2SO4}$ $0,1\,\mathrm{mol/L}$ avec $200\,\mathrm{mL}$ de $\ce{NaOH}$ $0,1\,\mathrm{mol/L}$ ?
Que vaut le $\ce{pH}$ d’une solution de $\ce{HCl}$ $0,025\,\mathrm{mol/L}$ ?
Que vaut le $\ce{pH}$ d’une solution de $\ce{NaOH}$ $0,0025\,\mathrm{mol/L}$ ?
Quel est le $\ce{pH}$ d'un mélange de $100\,\mathrm{mL}$ de $\ce{H2SO4}$ $0,1\,\mathrm{mol/L}$ avec $200\,\mathrm{mL}$ de $\ce{NaOH}$ $0,2\,\mathrm{mol/L}$ ?
Bibliographie
Voici quelques liens consultés et/ou repris tels quels. Merci à leurs auteurs pour le précieux partage de ces ressources: