Réactions chimiques
La suite du programme vous paraîtra sans doute logique: dans les chapitres précédents, nous avons appris à combiner les atomes pour former des molécules. Nous pourrions maintenant transformer les molécules obtenues en d'autres molécules: ceci serait un exemple de transformation chimique ou plus précisément de réaction chimique.
L'objectif de ce chapitre est d'aborder la notion de réaction chimique. On tentera de répondre à la question:
- comment les chimistes parviennent à transformer la matière, à partir de certaines substances (réactifs), pour en obtenir de nouvelles (produits) ?
Un exemple de réaction chimique :
Les atomes s'associent pour constituer des molécules. En faisant interagir plusieurs molécules entre elles, il est possible d'obtenir, après transformation, de nouvelles molécules : cela illustre une réaction chimique.
Prenons la réaction de combustion du méthane :

La combustion du méthane: peut-on perdre ou gagner des atomes au cours d'une réaction chimique ?
Dans toutes réactions chimiques il y a transformation d'une ou plusieurs substances en de nouvelles substances par suite du réarrangement des atomes initialement présents : à partir de substances connues nous obtenons de nouvelles substances.
Les réactions chimiques sont représentées par des schémas de réaction ou équations chimiques. La première partie d'un tel schéma est constituée par les formules des corps présents avant la réaction (réactifs) et la seconde par celles des corps formés au cours de la réaction (produits).
Transformations physiques et chimiques
Essayons maintenant de différencier une transformation physique d'une transformation chimique:

Brocoli: le vert de ce légume change durant la cuisson.
Le vert des légumes est dû à la chlorophylle, un pigment présent dans les chloroplastes des cellules végétales. L'air, présent dans les interstices entre les cellules végétales, atténue légèrement la couleur verte de la chlorophylle. Pendant les premières minutes de cuisson, l'air se dilate et s'échappe, rendant la couleur verte plus vive.
Après cette première étape, le vert s'atténue petit-à-petit. Pourquoi? Eh bien, la cuisson provoque la décomposition des cellules végétales, libérant des acides organiques. Les ions hydrogène de ces acides organiques réagissent avec la chlorophylle. Ils prennent la place du magnésium au centre de la chlorophylle, formant des phéophytines1.
Après lecture de ce texte, êtes-vous capable d'identifier une transformation physique et une chimique ?
Loi de conservation de la masse (LAVOISIER).
" Rien ne se perd, rien ne se crée, mais tout se transforme "
Au cours de la réaction chimique, il n'y a pas de perte de matière : il est donc nécessaire de retrouver dans le système initial et le système final le même nombre pour chaque élément.
Exemple de réaction chimique :
$$ \ce{H2 + O2 -> H2O} $$
Il n'y a pas dans le système initial et le système final le même nombre des mêmes atomes; il est donc nécessaire d'équilibrer ou de balancer l'équation en introduisant des coefficients stœchiométriques. Les formules brutes des molécules n'étant pas modifiables, on équilibre donc la réaction en complétant l'écriture par des coefficients placés uniquement devant les formules.
La nature des substances initiales et finales ne peut pas être modifiée par l'introduction de ces coefficients. Pour l'exemple précédent, on ne peut pas, afin d'équilibrer l'équation, écrire pour le système final $\ce{H2O2}$ en lieu et place de $\ce{H2O}$. On ne peut donc pas changer les nombres indicés de chaque élément.

De l'eau et de l'eau oxygénée: ce n'est pas pareil !
Il faut donc écrire : $\ce{2 H2 + O2 -> 2 H2O}$
L'équation est ainsi équilibrée. On dit qu'elle est stœchiométrique. Il est préférable d’utiliser les coefficients stœchiométriques entiers au lieu des fractions. Notez aussi que le coefficient stœchiométrique $1$ n'est jamais écrit.
Pour résumer, remarquez qu'une équation chimique indique :
-
Les formules et le nombre de particules constituant le système initial et final.
-
Les quantités relatives des substances qui entrent en réaction et qui se forment. L'équation chimique n'indique pas les conditions qui permettent à la réaction de se produire.
Quelques règles pour équilibrer une réaction:
- Equilibrer les métaux, les métaux de transition et les non-métaux.
- Equilibrer les ions complexes (exemples: $\ce{SO4^{2-}}$, $\ce{NO3^{-}}$, $\ce{OH^{-}}$, en considérant chaque ion complexe comme un groupe indivisible).
- Equilibrer les atomes d'hydrogène et d'oxygène.
- Vérifier.
Quelques règles sur les formules chimiques
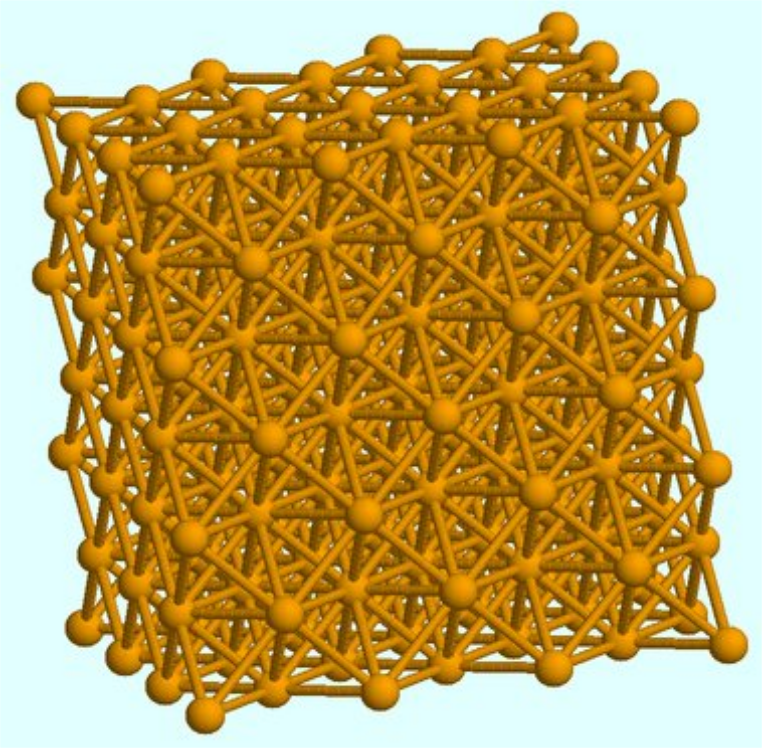
Voilà un minuscule bout de fer. Le fer est solide aux conditions ambiantes.
La formule chimique du fer est ………, comme l’élément chimique correspondant.
Tous les métaux sont solides aux conditions ambiantes, à l’exception du mercure.
La formule des corps simples, solides aux conditions ambiantes, est égale au symbole de l’élément correspondant.
La formule du mercure est $\ce{Hg}$, car sa structure ressemble à celle des métaux solides.
Autres corps simples solides : ………………………………………………..
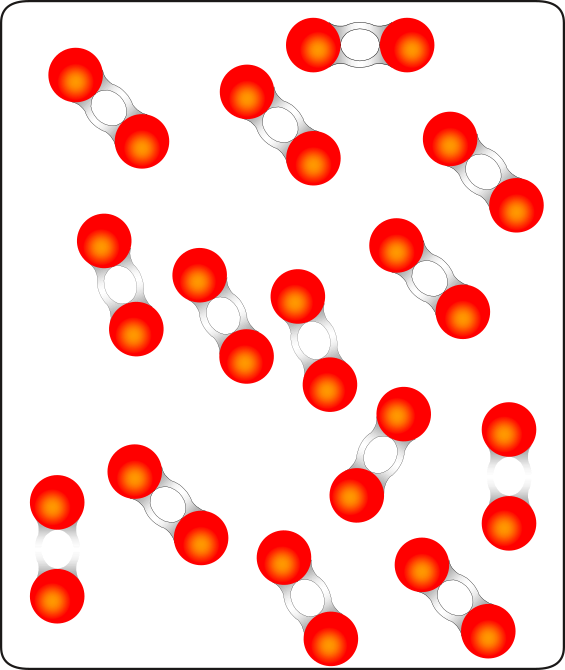
L’intérieur d’une bonbonne contenant de l’oxygène. L’oxygène est gazeux aux conditions ambiantes.
La formule de l’oxygène gazeux (molécule de dioxygène) est
…………
Autres corps simples gazeux : ………………………………………………….
La formule du brome liquide aux conditions ambiantes est ……………
La formule des corps simples, gazeux ou liquides aux conditions ambiantes, est égale à la formule de l’unité répétitive élémentaire (atome ou molécule).
Avec le mercure, le brome est le SEUL corps simple liquide à température ambiante.
Pour se souvenir des corps simples diatomiques aux conditions ambiantes, les anglophones disent:
Have No Fear of Ice Cold Bee r
Et en francais ? A vous de chercher ...
La rencontre des réactifs
Il n’existe pas de réaction à distance. Il faut en conséquence que les réactifs se rencontrent pour qu’une réaction puisse avoir lieu. Les réactifs peuvent se trouver sous plusieurs formes : solide, liquide, gaz ou encore en solution.
Lorsqu’on veut indiquer l'état d'une substance dans une équation chimique, on l'indique entre parenthèse et en indice après celle-ci.
La réaction chimique s'effectuera d'autant plus facilement que les substances régissant entreront facilement en contact les unes avec les autres.
Il sera donc généralement plus facile d'effectuer des réactions entre substances gazeuses ou liquides.
Nous verrons plus loin que l'emploi de solutions (=mélanges homogènes d'eau et d'une autre substance) facilitent ces contacts.
Exemples de réactions chimiques
Remarque : les équations qui suivent sont à équilibrer, si nécessaire.
| Réaction | |
|---|---|
| deux gaz : | $\ce{\quad NH3 \quad + \quad HCl \quad -> \quad NH4Cl}$ |
| solide et gaz: | $\ce{\quad Mg \quad + \quad O2 \quad -> \quad MgO}$ |
| solide et liquide : | $\ce{\quad C12H22O11 \quad ->[\ce{H2SO4}] \quad C \quad + \quad H2O}$ |
| deux solides : | $\ce{\quad Zn \quad + \quad S8 \quad -> \quad ZnS}$ |
| deux liquides : | $\ce{\quad H2SO4 \quad + \quad H2O \quad -> \quad SO4^2- \quad + \quad H3O+ }$ |
Energétique
Lors d'une réaction chimique, il y a généralement absorption ou dégagement d'énergie : le plus souvent sous forme de chaleur, mais aussi sous forme d'énergie électrique, électromagnétique ou mécanique.
-
Si, au cours d'une réaction chimique, il y a dégagement d'énergie, on dit que la réaction est exoénergétique. On emploie le mot exothermique si l'énergie est de la chaleur.
-
Si, au cours d'une réaction chimique, il y a absorption d'énergie, on dit que la réaction est endoénergétique. On emploie le mot endothermique si l'énergie est de la chaleur.
Exemples
- Chaleur :
- Lumière :
- Electricité :

Les diagrammes d'énergie pour quatre situations différentes.
Analogie pour l'énergétique dans les réactions chimiques
Ces images et le texte respectif sont tirés du site2.

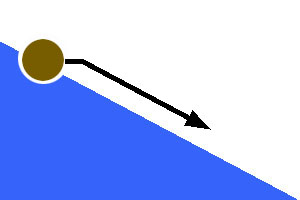
Réaction spontanée, sans énergie d’activation Il s'agit d'un phénomène aussi spontané qu'une bille dévalant une pente dès qu'on la lâche. Exemple : réaction de neutralisation.
Réaction avec énergie d’activation exemple le feu de bois, ou formation d’eau à partir de $\ce{H2}$ et $\ce{O2}$. On peut comparer l'amorçage à l'impulsion que l'on communique à une bille logée dans un léger creux pour qu'elle dévale spontanément une pente.

Les réactions chimiques imposées n'ont lieu que si on les provoque continuellement, comme on est obligé de pousser une bille pour la faire gravir une côte. Exemple : électrolyse de l’eau.
Exercices SERIE Réactions Chimiques A
Equilibrez les équations suivantes :
$\ce{\quad H2S \quad + \quad LiOH \quad -> \quad Li2S \quad + \quad H2O}$
$\ce{\quad Mg \quad + \quad H2O \quad -> \quad MgO \quad + \quad H2}$
$\ce{\quad Al \quad + \quad O2 \quad -> \quad Al2O3}$
$\ce{\quad Na2O \quad + \quad H2O \quad -> \quad NaOH}$
$\ce{\quad Fe2O3 \quad + \quad H2O \quad -> \quad Fe(OH)3}$
$\ce{\quad N2O5 \quad + \quad H2O \quad -> \quad HNO3}$
$\ce{\quad H2SO4 \quad + \quad Al(OH)3 \quad -> \quad Al2(SO4)3 \quad + \quad H2O}$
$\ce{\quad HNO3 \quad + \quad Fe(OH)3 \quad -> \quad Fe(NO3)3 \quad + \quad H2O}$
$\ce{\quad KOH \quad + \quad HBr \quad -> \quad KBr \quad + \quad H2O}$
$\ce{\quad H2SO3 \quad + \quad LiOH \quad -> \quad Li2SO3 \quad + \quad H2O}$
$\ce{\quad MnCl2 \quad + \quad NH4OH \quad -> \quad Mn(OH)2 \quad + \quad NH4Cl}$
$\ce{\quad FeCl3 \quad + \quad Na2CrO4 \quad -> \quad Fe2 (CrO4)3 \quad + \quad NaCl}$
$\ce{\quad BaCl2 \quad + \quad K2SO4 \quad -> \quad BaSO4 \quad + \quad KCl}$
$\ce{\quad ZnCl2 \quad + \quad Li2CO3 \quad -> \quad ZnCO3 \quad + \quad LiCl}$
Dissolution
Définition de Dissolution (ou mise en solution): formation d'un mélange homogène à partir de deux ou plusieurs substances.

Le soluté "disparaît", car il est parfaitement soluble dans le solvant. On a formé une solution.
Solubilité
La solubilité est la quantité en $g$ de soluté que l'on peut dissoudre dans un volume donné (exemple $1\,\mathrm{L}$ ou $100\,\mathrm{mL}$) de solvant à une température donnée. Par exemple, dans $1\,\mathrm{L}$ d'eau on peut dissoudre $358,5\,\mathrm{g}$ de $\ce{NaCl}$, à $20\,\mathrm{^\circ C}$.

La solution est saturée: le soluté ne peut plus se dissoudre.
Liaison Hydrogène
La molécule d'eau est polaire. Les molécules d'eau sont rapprochées et elles exercent les unes sur les autres des forces d'attraction. Il en résulte une liaison faible, nommée liaison hydrogène.
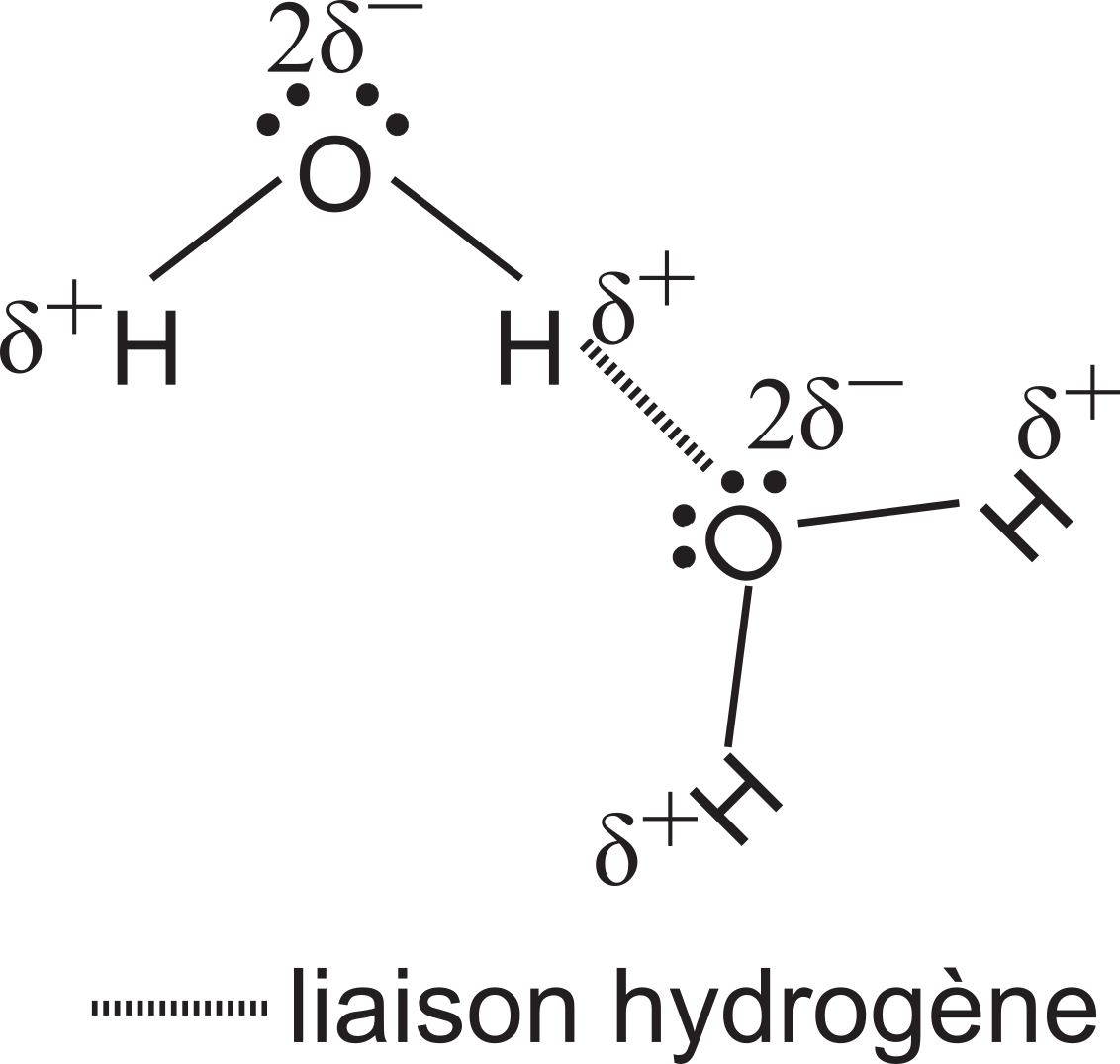
La liaison hydrogène est à la base de la tension superficielle de l'eau. C'est grâce à cette force que certains animaux (araignées, geckos) parviennent à marcher sur l'eau.
Dans l'eau (distillée), il n'y a pas de charges mobiles (pas d'ions): par conséquent, le courant ne peut pas passer et l'ampoule d'un circuit électrique transitant dans l'eau ne s'allumera pas .
Les électrolytes
Définition d'Electrolytes: substances qui, en solution dans l'eau, se dissocient en ions (positifs et négatifs). Les électrolytes conduisent le courant électrique. Les ions peuvent en effet transporter un courant électrique en se déplaçant dans la solution. Une condition suffisante pour qu'un composé soit un électrolyte est la présence de liaison(s) ionique(s).
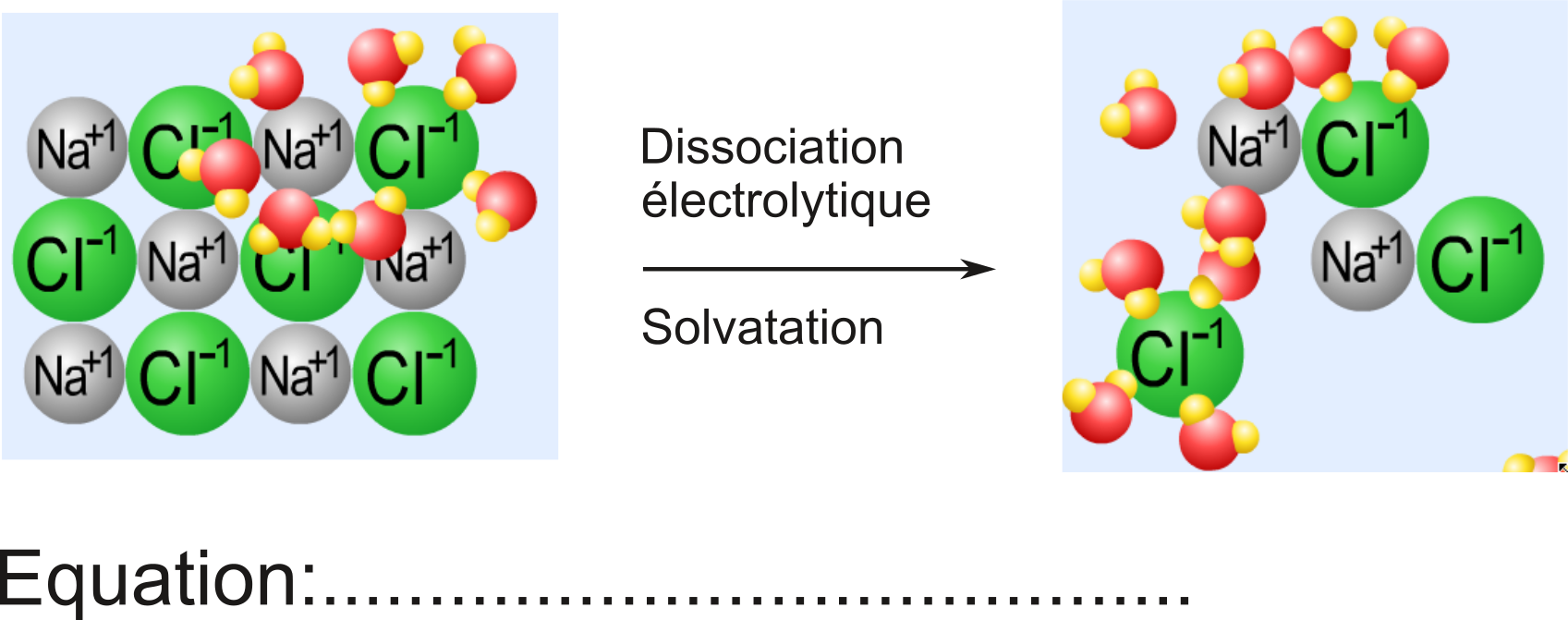
La dissolution de $\ce{NaCl}$. S'agit-il d'une simple dissolution ? Quelle est l'équation chimique correspondante?
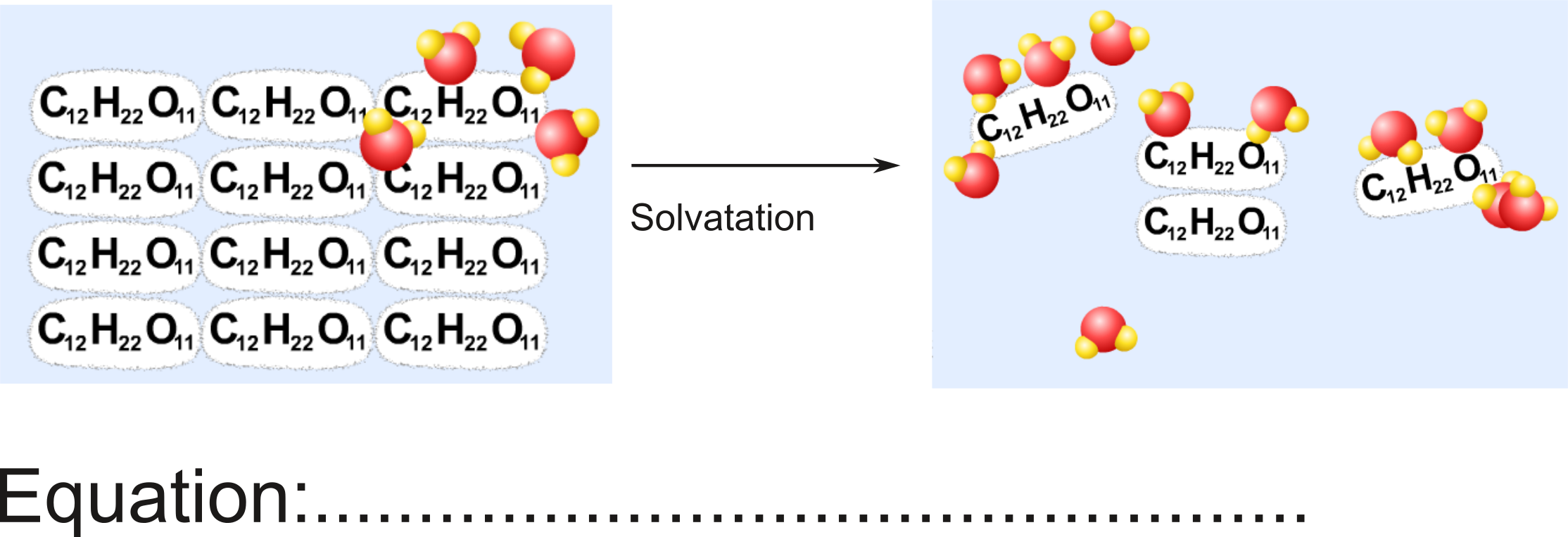
La dissolution du sucre $\ce{C12H22O11}$. S'agit-il d'une simple dissolution ? Quelle est l'équation chimique correspondante?
Conclusions pour les électrolytes
Sur la base des observations précédentes, que peut-on conclure ?
Que se passera-t-il si l'on immerge un circuit électrique dans ces deux solutions ?
L'ampoule s'allumera ou pas ?
Nous avons vu que certains composés (ioniques ou fortement polaires) se dissocient dans l'eau. Voici deux modèles nous permettant de comprendre comment la dissociation a lieu.

Voici un composé constitué de deux éléments (métal + non-métal): l'eau sépare le métal du non-métal.
Voici comment l'on écrit la dissociation du composé $\ce{CaF2}$ provoquée par l'eau:
$\ce{CaF2 -> Ca^2+ + 2F-}$
Que se passe-t-il dans le cas d'une molécule polyatomique ? Voici le modèle correspondant:

Voici un composé constitué de trois éléments (métal + non-métaux): l'eau sépare le métal des non-métaux. Notez (!) que les non-métaux restent ensemble dans un ion complexe (= constitué de minimum deux éléments).
Voici comment l'on écrit la dissociation du composé $\ce{Al2(SO4)3}$ provoquée par l'eau:
$\ce{Al2(SO4)3 -> 2Al^3+ + 3SO4^2-}$
Exercices SERIE Ions en solution
Complétez et équilibrez les équations de dissociation suivantes :
| a. | $\ce{BaS}$ | $\ce{->}$ | ||||
| b. | $\ce{CaCl2}$ | $\ce{->}$ | ||||
| c. | $\ce{CuF2}$ | $\ce{->}$ | ||||
| d. | $\ce{Ni2S3}$ | $\ce{->}$ | ||||
| e. | $\ce{FeCl3}$ | $\ce{->}$ | ||||
| f. | $\ce{CsBr}$ | $\ce{->}$ |
Molécules à $2$ éléments chimiques. Trouvez la formule brute à partir des ions ci-dessous. Il s'agit de les associer et d'obtenir la formule d'une molécule neutre:
$\ce{Li+}$ et $\ce{F-}$ :
$\ce{Fe^2+}$ et $\ce{S^2-}$ :
$\ce{Al^3+}$ et $\ce{S^2-}$ :
Complétez et équilibrez les équations de dissociation suivantes :
| a. | $\ce{K2SO4}$ | $\ce{->}$ | ||||
| b. | $\ce{Ba(NO3)2}$ | $\ce{->}$ | ||||
| c. | $\ce{Mg3(PO4)2}$ | $\ce{->}$ |
Molécules à $3$ éléments chimiques. Trouvez la formule brute à partir des ions ci-dessous. Il s'agit de les associer et d'obtenir la formule d'une molécule neutre:
$\ce{Li+}$ et $\ce{NO2^-}$ :
$\ce{Fe^3+}$ et $\ce{SO4^2-}$ :
$\ce{Ga^3+}$ et $\ce{OH^-}$ :
Dans une solution aqueuse on trouve les ions suivants :

Quelles sont les substances qui ont bien pu donner ces ions?
Donnez leurs formules brutes.
Complétez et équilibrez les équations suivantes :
| a. | $\ce{K^+}$ | $\ce{+}$ | $\ce{NO3^-}$ | $\ce{->}$ | |
| b. | $\ce{Mg^2+}$ | $\ce{+}$ | $\ce{NO3^-}$ | $\ce{->}$ | |
| c. | $\ce{Al^3+}$ | $\ce{+}$ | $\ce{NO3^-}$ | $\ce{->}$ | |
| d. | $\ce{Na+}$ | $\ce{+}$ | $\ce{SO4^2-}$ | $\ce{->}$ | |
| e. | $\ce{Ba^2+}$ | $\ce{+}$ | $\ce{SO4^2-}$ | $\ce{->}$ | |
| f. | $\ce{Ga^3+}$ | $\ce{+}$ | $\ce{SO4^2-}$ | $\ce{->}$ | |
| g. | $\ce{Li+}$ | $\ce{+}$ | $\ce{PO4^3-}$ | $\ce{->}$ | |
| h. | $\ce{Sr^2+}$ | $\ce{+}$ | $\ce{PO4^3-}$ | $\ce{->}$ | |
| i. | $\ce{Al^3+}$ | $\ce{+}$ | $\ce{PO4^3-}$ | $\ce{->}$ |
Complétez et équilibrez les équations de dissociation suivantes :
| a. | $\ce{LiOH}$ | $\ce{->}$ | ||||
| b. | $\ce{H2SO4}$ | $\ce{->}$ | ||||
| c. | $\ce{Ba(OH)2}$ | $\ce{->}$ | ||||
| d. | $\ce{Ca(NO3)2}$ | $\ce{->}$ |
Complétez et équilibrez les équations de dissociation suivantes
| a. | $\ce{CuCl2}$ | $\ce{->}$ | ||||
| b. | $\ce{Fe(OH)3}$ | $\ce{->}$ | ||||
| c. | $\ce{Fe(NO2)2}$ | $\ce{->}$ | ||||
| d. | $\ce{->}$ | $\ce{K+}$ | $\ce{+}$ | $\ce{MnO4^-}$ | ||
| e. | $\ce{->}$ | $\ce{Pb^4+}$ | $\ce{+}$ | $\ce{CrO4^2-}$ |
Réactions de précipitation
Les réactions de précipitation sont des réactions de déplacement. Elles se basent sur la dissociation dans l'eau de composés solubles et sur le déplacement conséquent qui aboutit à la formation d'un composé insoluble.
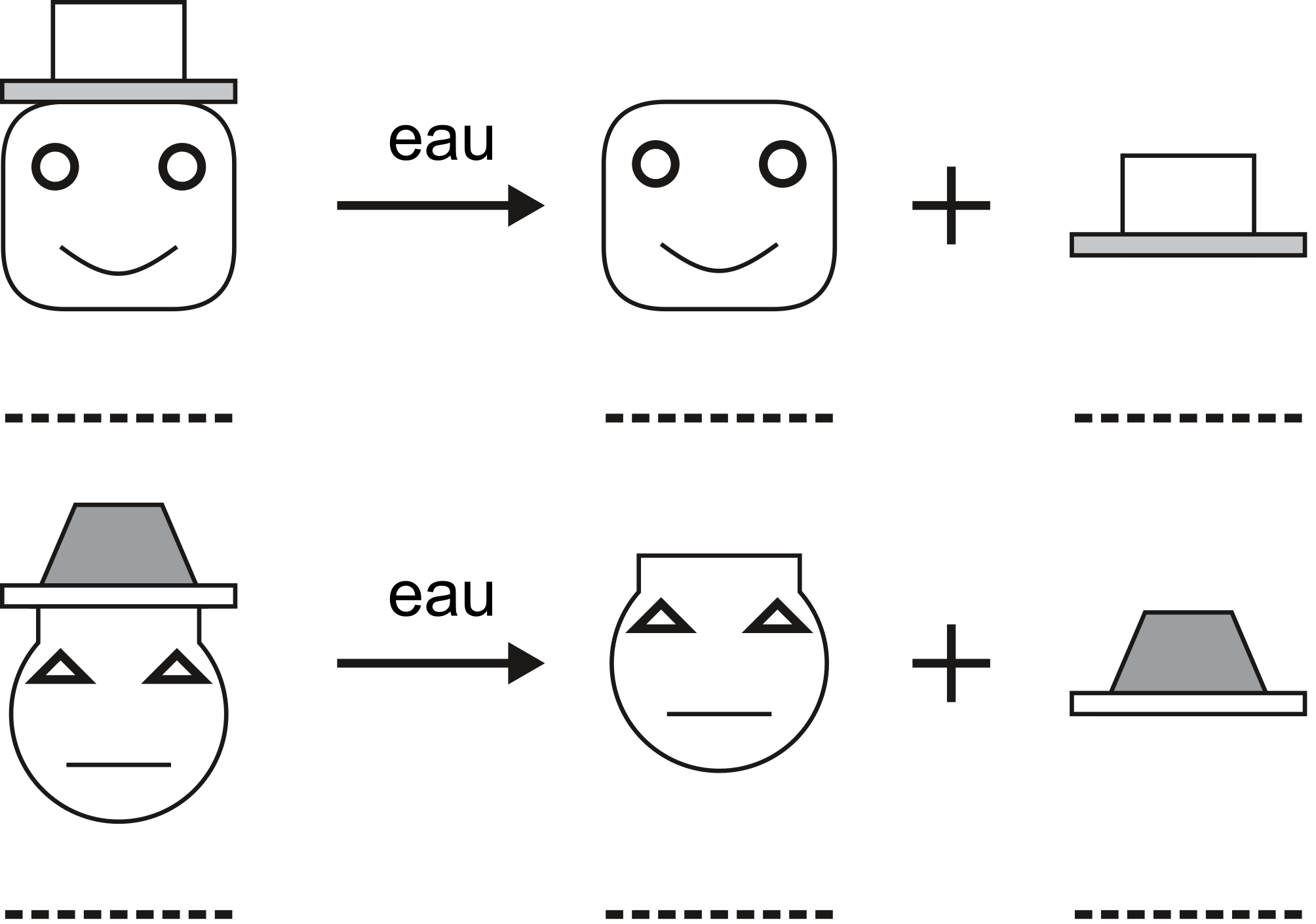
Les composés ioniques ou fortement polaires se dissocient dans l'eau. On nomme ce phénomène, la dissociation électrolytique..
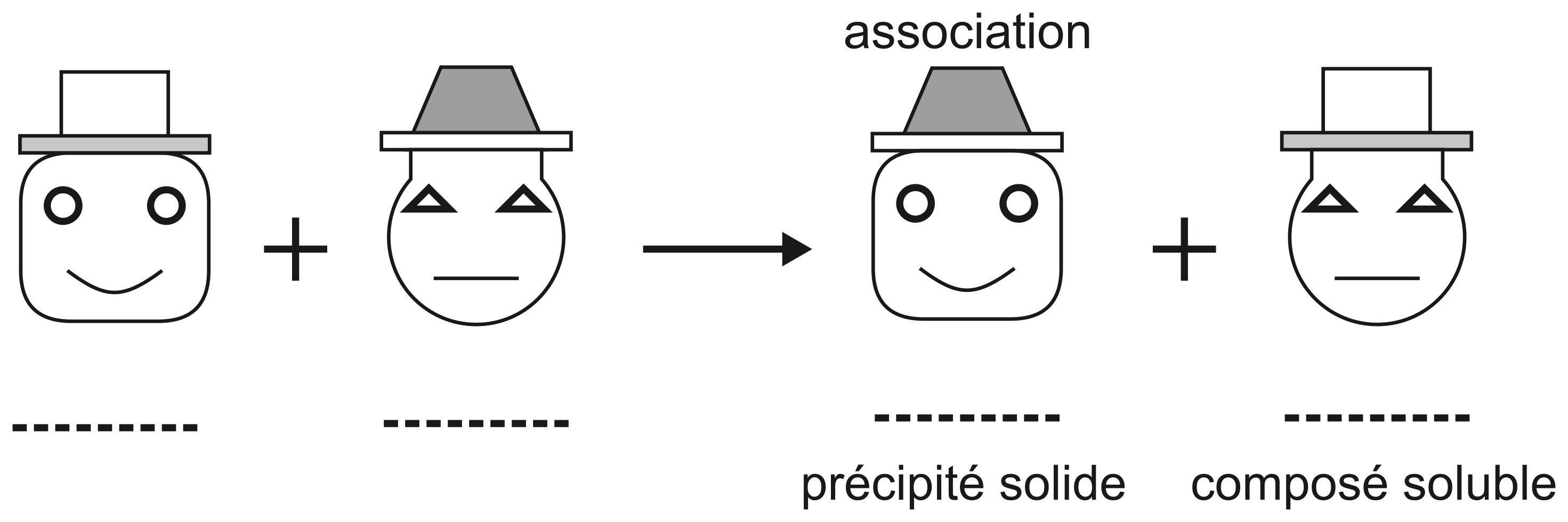
Et voici le déplacement qui mène à la précipitation d'un composé insoluble dans l'eau, nommé le précipité. Le composé soluble reste en solution, sous forme d'ions séparés.
Définition de réaction de précipitation: réaction ionique qui se produit quand les deux ions (cation et anion) d'une molécule insoluble se rencontrent. Ces deux ions se combinent pour former une molécule et donnent un solide appelé précipité.
Analyse qualitative
L'analyse qualitative consiste à mettre en évidence les divers corps chimiques (anions, cations, etc.) qui peuvent exister dans une solution.
Pour procéder à cette analyse, on utilise des réactifs spécifiques. La formation d'un précipité et la couleur de celui-ci vont nous permettre d'identifier un ion présent en solution.
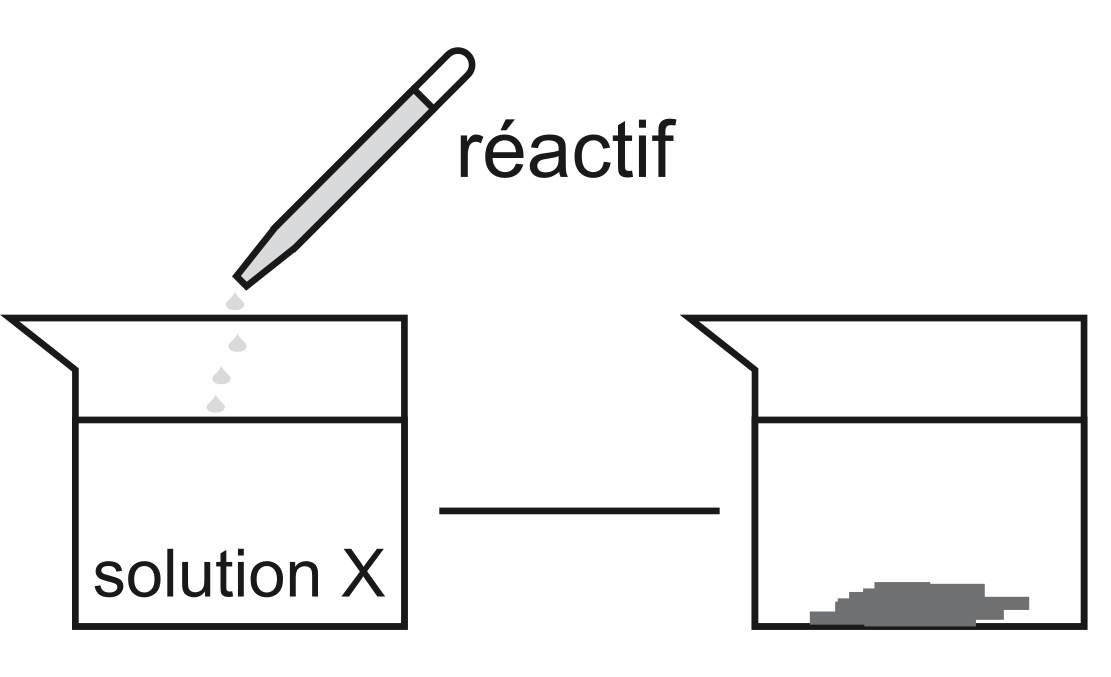
L'ajout d'un réactif permet d'obtenir un précipité.
A l'aide d'un tableau des couleur (cf. exercices), nous sommes en mesure d'identifier un ion éventuellement présent
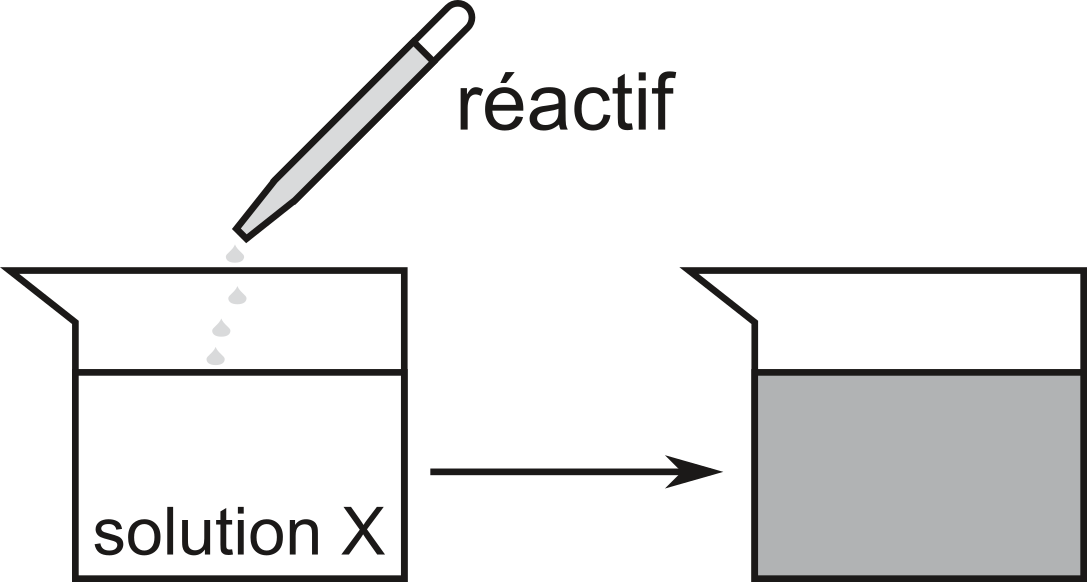
La nouvelle coloration liée à la formation d'un précipité nous permet d'identifier l'ion qui était présent dans la solution de départ.
Exercices SERIE Réactions de précipitation
Soit la réaction suivante :
| $\ce{CaBr2}$ | $\ce{+}$ | $\ce{Na2CO3}$ | $\ce{->}$ |

Les particules en solution avant et après précipitation. Dessin à compléter !
Quelles sont les particules dans les récipients 1, 2 et 3 ?
Que voit-on dans le récipient 3 ?
Complétez les équations chimiques suivantes et indiquez le précipité :
| a. | $\ce{NaCl}$ | $\ce{+}$ | $\ce{KNO3}$ | $\ce{->}$ | |
| b. | $\ce{NaCl}$ | $\ce{+}$ | $\ce{AgNO3}$ | $\ce{->}$ | |
| c. | $\ce{KI}$ | $\ce{+}$ | $\ce{H2CO3}$ | $\ce{->}$ |
Complétez l'équation globale, équilibrez, indiquez le précipité et donnez l'équation ionique:
| a. | $\ce{BaF2}$ | $\ce{+}$ | $\ce{Na2CO3}$ | $\ce{->}$ | ||||
| b. | $\ce{NiCl3}$ | $\ce{+}$ | $\ce{H2S}$ | $\ce{->}$ | ||||
| c. | $\ce{H3PO4}$ | $\ce{+}$ | $\ce{BaCl2}$ | $\ce{->}$ | ||||
| d. | $\ce{Na2CrO4}$ | $\ce{+}$ | $\ce{Pb(NO3)2}$ | $\ce{->}$ | ||||
| e. | $\ce{+}$ | $\ce{->}$ | $\ce{K2SO4 }$ | $\ce{+}$ | $\ce{Fe(OH)3}$ |
Complétez l'équation globale, équilibrez, indiquez le précipité et donnez l'équation ionique:
| a. | $\ce{Co^2+}$ | $\ce{+}$ | $\ce{Na3PO4}$ | $\ce{->}$ | ||||
| b. | $\ce{ Ba^2+ }$ | $\ce{+}$ | $\ce{K2SO4}$ | $\ce{->}$ | ||||
| c. | $\ce{CO3^2-}$ | $\ce{+}$ | $\ce{AgNO3}$ | $\ce{->}$ | ||||
| d. | $\ce{PO4^3-}$ | $\ce{+}$ | $\ce{Ni(NO3)2}$ | $\ce{->}$ | ||||
| e. | $\ce{Mn^2+}$ | $\ce{+}$ | $\ce{NaOH}$ | $\ce{->}$ |
Quel pourrait être le réactif du :
$\ce{Cu^2+}$ sachant qu'il précipite sous forme d'hydroxyde ?
$\ce{Cl-}$ sachant qu'il précipite sous forme de chlorure d'argent ?
Sachant que le réactif de $\ce{Ni^2+}$ est $\ce{(NH4)2S}$, donnez l'équation de précipitation équilibrée.
Sachant que le cation $\ce{Ni^2+}$ peut précipiter sous forme de sulfure et de phosphate, choisir deux réactifs l'un permettant de faire précipiter $\ce{Ni^2+}$ sous forme de sulfure et l'autre sous forme de phosphate. Établir et équilibrer ces deux équations de précipitation.
Soit le tableau des réactions spécifiques des ions suivants :
| ion | nom du réactif | formule du réactif | couleur du précipité | formule du précipité |
|---|---|---|---|---|
| $\ce{SO4^2-}$ | chlorure de baryum | $\ce{BaCl2}$ | blanc | $\ce{BaSO4}$ |
| $\ce{Cl-}$ | nitrate d'argent | $\ce{AgNO3}$ | blanc | $\ce{AgCl}$ |
| $\ce{Fe^2+}$ | hydroxyde de sodium | $\ce{NaOH}$ | vert bouteille | $\ce{Fe(OH)2}$ |
| $\ce{Fe^3+}$ | hydroxyde de sodium | $\ce{NaOH}$ | rouille/brun | $\ce{Fe(OH)3}$ |
| $\ce{Cu^2+}$ | hydroxyde de sodium | $\ce{NaOH}$ | bleu royal | $\ce{Cu(OH)2}$ |
| $\ce{Pb^2+}$ | chromate de potassium | $\ce{K2CrO4}$ | jaune | $\ce{PbCrO4}$ |
| $\ce{Co^2+}$ | carbonate de sodium | $\ce{Na2CO3}$ | mauve | $\ce{CoCO3}$ |
| $\ce{Cr^3+}$ | phosphate de sodium | $\ce{Na3PO4}$ | gris-vert | $\ce{CrPO4}$ |
Sur la base du tableau ci-dessus, complétez le tableau suivant :
| substance à analyser |
ions en solution |
réactif utilisé |
précipitation (oui/non) |
couleur du précipité |
équation de précipitation |
|---|---|---|---|---|---|
| $\ce{KCl}$ | $\ce{K^+}$/$\ce{Cl^-}$ | $\ce{NaOH}$ | |||
| $\ce{AgNO3}$ | $\ce{HCl}$ | ||||
| $\quad / \ce{Cl^-}$ | $\ce{NaOH}$ | oui | rouille | ||
| $\ce{Na2SO4}$ | $\ce{BaCl2}$ | ||||
| $\ce{KNO3}$ | $\ce{BaCl2}$ | ||||
| $\ce{NaOH}$ | $\ce{CuCl2}$ |
En analysant un sel inconnu au laboratoire, on a obtenu les résultats suivants :
| Réactif | Réaction positive ou négative |
Couleur du précipité |
|---|---|---|
| $\ce{BaCl2}$ | négative | --------- |
| $\ce{AgNO3}$ | positive | blanc |
| $\ce{NaOH}$ | négative | --------- |
| $\ce{Na2CO3}$ | positive | mauve |
En vous basant sur le tableau des réactions spécifiques des ions (cf. page précédante), trouvez le cation et l'anion de ce sel ainsi que les équations des réactions spécifiques qui ont été observées.
Donnez la formule du sel.
Soit le tableau de référence utilisé dans l’identification de ions :
| Ion à identifier | Ions spécifiques | formule brute du précipité | couleur du précipité |
|---|---|---|---|
| $\ce{Cu^2+}$ | $\ce{OH-}$ | $\ce{Cu(OH)2}$ | Précipité bleu |
| $\ce{Ag^+}$ | $\ce{OH-}$ | $\ce{AgOH}$ | Précipité brun |
| $\ce{Fe^2+}$ | $\ce{OH-}$ | $\ce{Fe(OH)2}$ | Précipité vert |
| $\ce{Fe^3+}$ | $\ce{OH-}$ | $\ce{Fe(OH)3}$ | Précipité brun |
| $\ce{Cl^-}$ | $\ce{Ag^+}$ | $\ce{AgCl}$ | Précipité blanc |
| $\ce{SO4^2-}$ | $\ce{Ba^2+}$ | $\ce{BaSO4}$ | Précipité blanc |
Une solution inconnue forme un précipite brun avec du $\ce{NaOH}$ et ne précipite pas avec $\ce{NaCl}$. Que pouvez-vous en déduire ? Expliquez.
La solution inconnue forme un précipité blanc avec le $\ce{BaCl2}$. Que pouvez-vous en déduire ? Expliquez.
Sur la base des réponses en a) et b), donnez la formule brute du sel inconnu dissous dans la solution initiale.
Acides et Bases
Certaines substances covalentes peuvent aussi se dissocier dans l'eau, bien que leurs molécules ne contiennent pas d'ions.
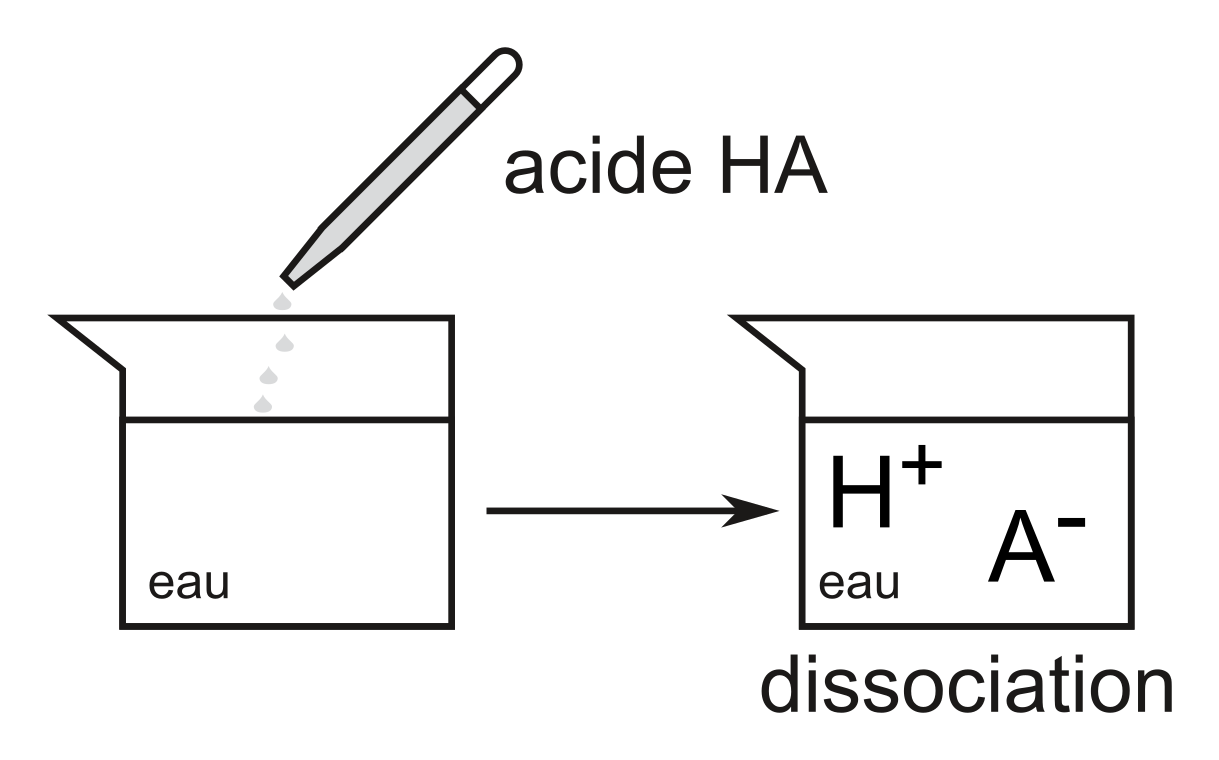
Un acide est un donneur de protons ($\ce{H+}$), selon la définition du chimiste danois Joannes Brønsted
Plus précisément, un proton dans l'eau est solvaté par $4$ molécules d'$\ce{H2O}$:
$\ce{H+ + 4 H2O -> H9O4^+}$
Pour simplifier, un proton en solution aqueuse peut être indiqué par l'abréviation: $\ce{H^+_{aq}}$.
Un acide est un donneur de protons: on le nomme acide de Brønsted, d'après le scientifique danois qui est connu pour ses travaux sur les solutions aqueuses.
D'autres exemples d'acides:
| $\ce{HCl}$ | $\ce{->} $ | $\qquad$ | $\ce{+}$ | |
| $\ce{H2SO4}$ | $\ce{->} $ | $\qquad$ | $\ce{+}$ |
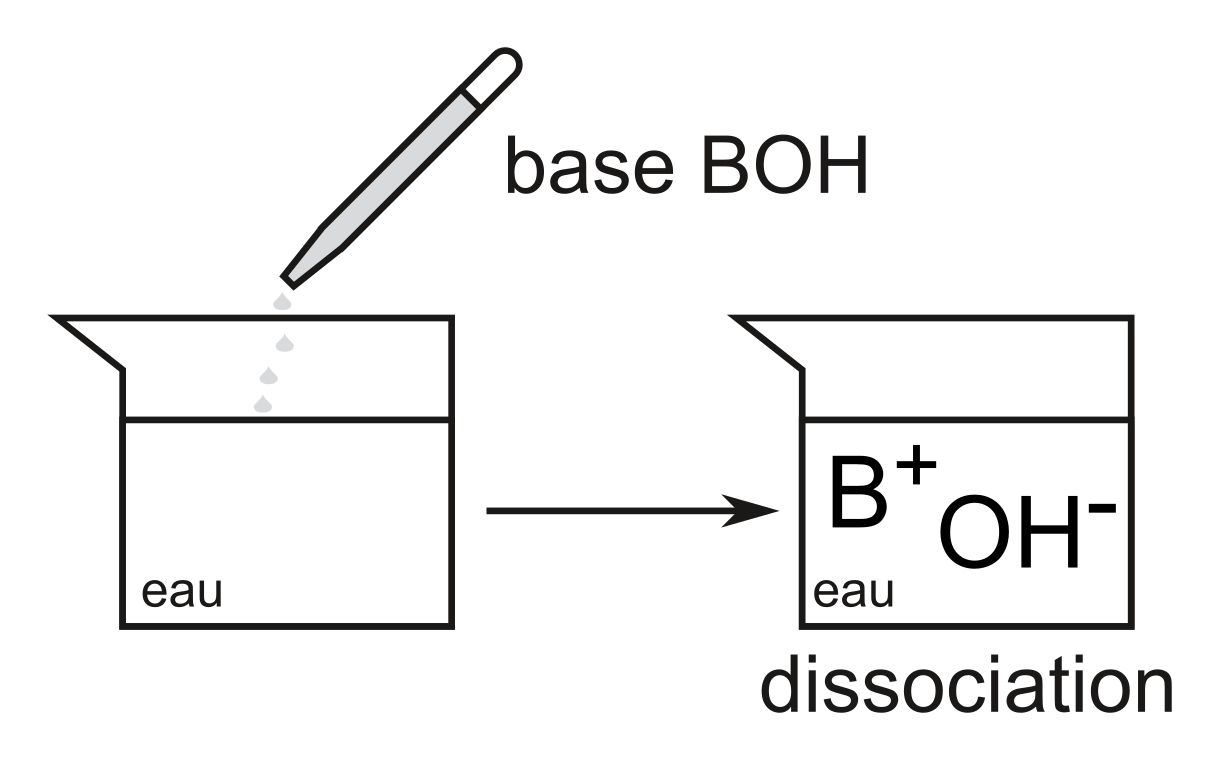
Une base donne des ions $\ce{OH-}$.
Une base libère des ions $\ce{OH-}$: elle est donc un accepteur de protons (base de Brønsted), car les ions $\ce{OH-}$ peuvent capter les ions $\ce{H+}$ provenant d'un acide.
Quelle molècule va se former à la suite de cette réaction ?
$\ce{OH- + \qquad -> }$
D'autres exemples de bases:
| $\ce{Ca(OH)2}$ | $\ce{->} $ | $\qquad$ | $\ce{+}$ | ||
| $\ce{NH3}$ | $\ce{+}$ | $\qquad$ | $\ce{->} $ | $\qquad$ | $\ce{+}$ |
Réactions de neutralisation
Définition de Neutralisation: réaction chimique entre un acide et une base, donnant de l'eau et le sel correspondant de l'acide. Exemple: $\ce{HCl + NaOH -> }$
Le $\ce{pH}$ est une échelle de valeurs numériques utile à mesurer l'acidité d'une solution. Le $\ce{pH}$ est directement lié à la quantité d'ions $\ce{H^+_{aq}}$, présents en solution. Souvent la valeur du $\ce{pH}$ est indiquée sur les étiquettes de certains produits (ex. eau, shampooing).
| $\ce{pH} < 7$ | $\ce{pH} =7$ | $\ce{pH} >7$ |
|---|---|---|
| solution acide | solution neutre | solution basique (ou alcaline) |
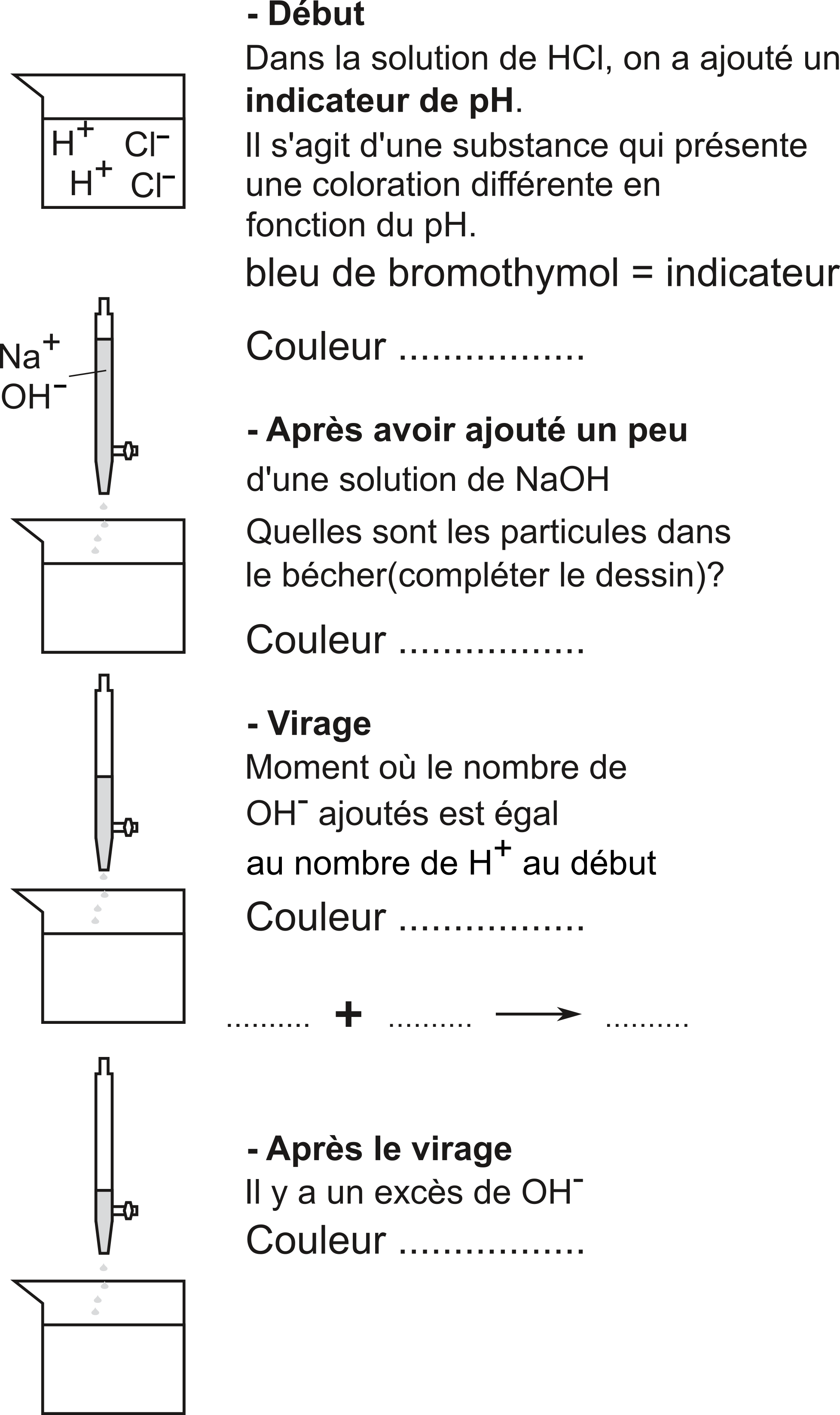
Les étapes d'une expérience de neutralisation. Au départ, nous avons une solution acide. Nous utiliserons ainsi une base pour neutraliser l'acide.
L'eau, molécule polaire, est nécessaire à la dissociation des acides et des bases, eux aussi molécules polaires. Sans hydratation (=solvatation par l'eau), il n'y aurait pas de dissociation.

Les valeurs typiques du $\ce{pH}$ de solutions aqueuses courantes: les cases grises indiquent les $\ce{pH}$ des liquides corrosifs.
Exercices SERIE Réactions de neutralisation
Un exemple de neutralisation.
Dans quel milieu se passe la réaction de neutralisation ?
Est-ce indispensable ? Si oui, pourquoi ?
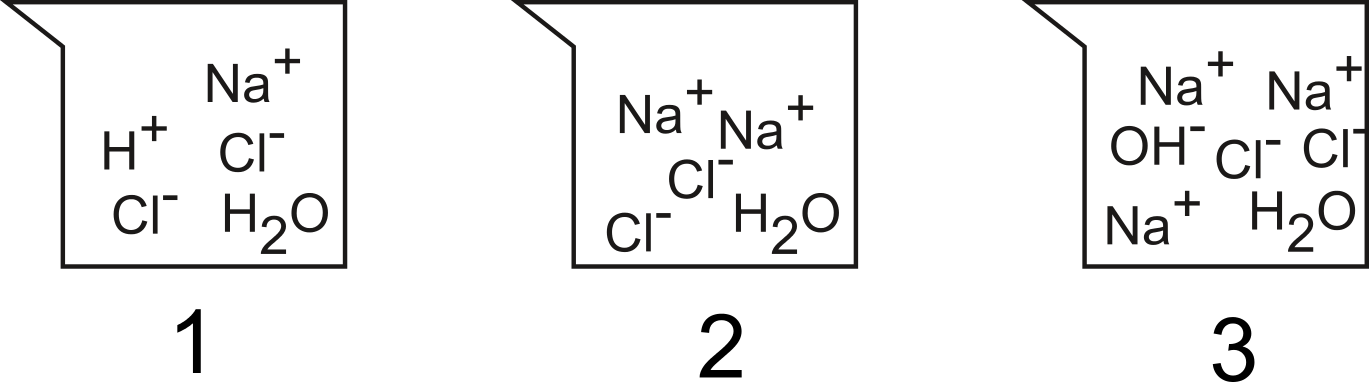
Quelles sont les particules (molécules ou ions) dans le récipient $1$, $2$ et $3$ ?

Les particules en solution avant et après neutralisation. Dessin à compléter !
| $\ce{H2SO4}$ | $\ce{+}$ | $\ce{LiOH}$ | $\ce{->}$ |
Qu'appelle-t-on un milieu acide ? Comment le mettre en évidence ?
Qu'appelle-t-on un milieu basique ? Comment le mettre en évidence ?
Dans ces 3 récipients, y a-t-il une solution neutre ? Si oui, laquelle ?
Solutions acides, basiques ou neutres ?
Y a-t-il une solution acide ? Si oui, laquelle ?
Y a-t-il une solution basique ? Si oui, laquelle ?
Une neutralisation est la réaction de : (entourez la ou les bonne(s) réponse(s))
un sel + eau
un hydroxyde + eau
un acide + un hydroxyde
un sel + une base
un acide + un oxyde
Peut-on neutraliser $\ce{HCl}$ par $\ce{H2SO4}$ ? Justifiez la réponse donnée. Si oui, donnez l'équation de neutralisation, sinon, dire pourquoi.
Peut-on obtenir du $\ce{Na2SO3}$ en neutralisant $\ce{NaOH}$ par $\ce{H2SO4}$ ? Si oui, donnez l'équation de neutralisation, sinon, dire pourquoi.
Soit le tableau de référence :
| INDICATEUR | ACIDE | BASIQUE | NEUTRE |
|---|---|---|---|
| chou rouge | rouge | vert | violet foncé |
| phénolphtaléine | incolore | rose-violet | incolore |
| tournesol | rose | bleu | violet pâle |
| papier $\ce{pH}$ | rouge $\ce{pH}\quad 0-6$ |
bleu $\ce{pH\quad 8-14}$ |
vert $\ce{pH\quad 7}$ |
En utilisant le tableau précédent, complétez :
| Produit | Indicateur | Couleur | acide, basique ou neutre |
|---|---|---|---|
| aspirine (acide acétylsalicylique) |
tournesol | ||
| Ajax | bleu | ||
| vinaigre | rouge $\ce{pH}\quad 0-6$ |
||
| citron (acide citrique) |
Complétez et équilibrez les équations de neutralisation suivantes :
| a. | $\ce{H3PO4}$ | $\ce{+}$ | $\ce{LiOH}$ | $\ce{->}$ | ||||
| b. | $\ce{H2CO3}$ | $\ce{+}$ | $\ce{KOH}$ | $\ce{->}$ | ||||
| c. | $\ce{H2S}$ | $\ce{+}$ | $\ce{Al(OH)3}$ | $\ce{->}$ | ||||
| d. | $\ce{+}$ | $\ce{CuOH}$ | $\ce{->}$ | $\ce{Cu2SO3 }$ | $\ce{+}$ | |||
| e. | $\ce{HCl}$ | $\ce{+}$ | $\ce{->}$ | $\ce{FeCl2 }$ | $\ce{+}$ |
Trouvez l'acide et l'hydroxyde qui ont formé les sels suivants :
$\ce{Al(NO3)3}$
$\ce{NiS}$
Donnez l'équation de neutralisation équilibrée, de l'acide phosphorique par l'hydroxyde de calcium.
Sachant que dans un bécher on a du $\ce{H2SO4}$ avec du bleu de bromothymol et que la solution est jaune:
Quels sont les ions présents ?
On ajoute du $\ce{NaOH}$, mais la solution est toujours jaune. Quels ions avons-nous dans le bécher ?
On continue à ajouter du $\ce{NaOH}$. Au moment du changement de couleur, que se passe-t-il ?
Quels ions aurons-nous, si l'on ajoute encore du $\ce{NaOH}$ ? La solution sera-t-elle acide, basique ou neutre ?
Bibliographie
Voici quelques liens consultés et/ou repris tels quels. Merci à leurs auteurs pour le précieux partage de ces ressources: